DREADDs技術對GPC信號通路的影響
如何在體內環(huán)境條件下研究復雜多樣的 G 蛋白偶聯(lián)受體信號通路?這是擺在科研人員面前的一大難題,“只能由設計藥物激活的設計受體”——DREADDs 技術的出現解決了這個難題。并且,DREADDs 的出現改變了基礎和轉化神經科學的研究。
化學遺傳學 (Chemogenetics) 是指一種蛋白被改造與先前未被識別的小分子化合物相互作用的過程。多種蛋白的改造已被報道,包括激酶、非激酶的酶類、G 蛋白偶聯(lián)受體 (GPCRs) 和配體門控離子通道�;瘜W遺傳學技術 DREADDs (Designer receptors exclusively activated by designer drugs) 被廣泛應用于神經科學中,并被稱為通過 G 蛋白信號通路選擇性操作細胞活力的生物學“鎖和鑰匙” (Lock-and-key) 系統(tǒng)。
G 蛋白偶聯(lián)受體
G 蛋白偶聯(lián)受體 (G-protein-coupled receptors, GPCRs) 是人類基因組中最大的蛋白質超家族。GPCRs 是一大類七次跨膜的受體蛋白,通過與 G 蛋白偶聯(lián),隨后調節(jié)多種細胞內信號級聯(lián)反應,以響應激素、神經遞質、離子、光、氣味、趨化因子和其他刺激 ,參與了眾多生理過程包括感光、嗅覺、行為和情緒的調節(jié)、自主神經系統(tǒng)的調節(jié)、免疫系統(tǒng)的調節(jié)等。GPCRs 在生理學和疾病中扮演著重要的角色,是非常有吸引力的藥物靶點。
經典的 GPCR 信號轉導依賴于受體介導的異源三聚體 G 蛋白的激活。異源三聚體 G 蛋白由 Gα、Gβ 和 Gγ 三個亞基組成,其中 Gα 亞基可以與鳥苷二磷酸 (GDP) 結合,具有 GTP 水解酶活性。當 G 蛋白處于非活化態(tài)時,為異三聚體,Gα 亞基與 GDP 結合。經典 GPCR 通路活化:
不同類型的 GPCRs 與細胞外各種配體 (胞外第一信使) 結合從而接受外界的信號刺激,然后 GPCRs 被活化。
→ → GPCRs 與 G 蛋白結合形成復合體,G 蛋白 Gα 亞基構象發(fā)生改變并排斥 GDP,轉而結合 GTP,G 蛋白活化。
→ → G 蛋白再激活其下游的各種效應器,產生細胞內的第二信使,如環(huán)磷酸腺苷 (cAMP)、環(huán)鳥苷酸 (cGMP)、肌醇三磷酸 (IP3)、磷脂酰肌醇-4,5-二磷酸 (PIP2)、Ca2+ 和 NO 等,從而將信號逐級傳遞下去,最終細胞響應各類刺激產生不同的興奮性變化。
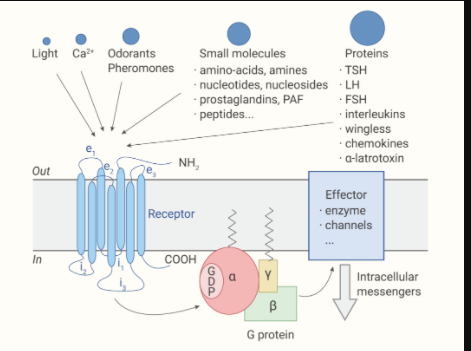
圖 1. G 蛋白偶聯(lián)受體的模式圖[10]
非經典的 GPCR 信號轉導依賴于小 G 蛋白 (Small G proteins) 的激活,小 G 蛋白通常是由大約 200 個氨基酸組成的單一多肽,同樣具有 GTP 水解酶活性。
GPCRs 廣泛分布于各個組織器官,其內源性和外源性配體、細胞功的多樣性,以及 G 蛋白家族的復雜多樣,都使得體內特定 GPCR 信號通路的探究之路困難重重。DREADDs 這時候就出場啦~
DREADDs 技術的降生
1991 年,Strader 等人首次嘗試改造 GPCRs,然后使用外源性的人工合成配體激活改造后的 GPCRs,激活特定的 GPCR 信號通路�?上У氖牵麄兪褂玫暮铣膳潴w的效力太低,無法用于進一步的體內研究。
1998 年,Coward 等人創(chuàng)造了一種突變的 κ 阿片受體 (KOR),并命名為 Ro1 和 Ro2,Ro1 和 Ro2 對天然的阿片肽配體不敏感,但對合成的KOR激動劑有反應。此后,更多的 GPCRs 被改造,成功的應用于特定的 GPCR 信號通路的體內研究。被改造的 GPCRs 稱為 RASSLs,這一方法則被稱為 RASSLs 技術,可以作為簡化 GPCR 信號通路復雜性的工具。不過 RASSLs 技術仍然存在一些局限:
1. 其配體對天然受體具有明顯的親和力和效力 (非選擇性活性),限制了RASSLs在體內的應用;
2. 缺少體內高效力配體;
3. 合成配體可能與其他蛋白靶點有親和力;
4. 許多 RASSLs 受體在體內有高基礎信號,會掩蓋合成配體誘導的表型。
Pei Y 等人在 2008 年正式提出了使用 DREADDs 技術克服 RASSLs 技術的局限性。DREADDs 與 RASSLs 技術原理相同,兩者都是將不同的 GPCRs 進行改造,使改造后 GPCRs 只接受外源性的人工合成配體的信號,并激活相應的 GPCR 信號通路,從而引發(fā)細胞不同的變化。RASSLs 受體大多是單突變體,對于一些天然配體仍然有反應,DREADDs 則對天然配體無反應。
常見的 DREADDs 受體包括 hM3Dq 、hM4Di 和 GsD (引起 Gs 相關信號通路激活) 均是雙位點突變,對天然配體無反應,這降低了體內基礎信號產生的幾率。
PS:此前 Blaine N. Armbruster 等人鑒定出人毒蕈堿乙酰膽堿受體 (mAChR) 3 亞型的雙突變體 (Y149C3.33/A239G5.46),即 hM3Dq,以及 4 亞型的雙突變體 (Y149C3.33/A239G5.46),即 hM4Di。hM3Dq 和 hM4Di 對天然配體乙酰膽堿 (Ach) 無反應,但是可以被小分子疊氮平-N-氧化物 (CNO) 激活。hM3Dq 被 CNO 激活時引起 Gαq 相關信號通路的激活,hM4Di 被 CNO 激活時能有效抑制 cAMP 的產生,激活 Gi 相關信號通路。
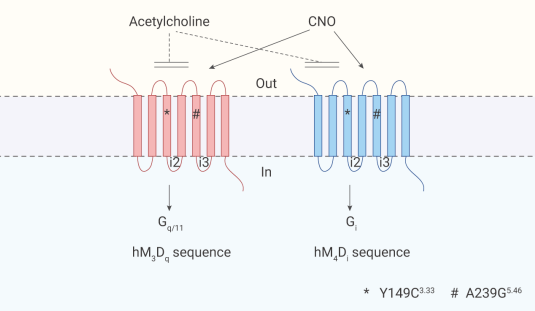
圖 2. hM3Dq 和 hM4Di 受體結構示意圖
CNO 與 DREADDs 受體的親和力也更高,可以作為高效配體在各類動物體內廣泛應用。此外,CNO 具有類似藥物的特性,但在藥理學上是惰性的,缺乏明顯的脫靶作用,這也減少了合成配體與其他蛋白質靶點結合的可能性。
DREADDs 技術的現狀
目前,DREADDs 技術廣泛用于神經元的相關研究,操作步驟可以概括如下:
1、選定并改造合適的 DREADDs 受體;
2、通過轉基因動物或病毒載體,將 DREADDs 受體基因導入動物體內。目前已開發(fā)出攜帶 DREADDs 受體轉基因的重組腺相關病毒 (AAV) 載體,通過添加細胞特異性啟動子,配合立體定位注射的方法,實現 DREADD 受體基因在不同組織細胞內的精準表達。如果使用 Cre-Lox P 的條件性基因敲除動物可進一步實現基因的條件可控性表達;
3、對動物進行 CNO 給藥 (控制時間或劑量);
4、DREADDs 受體的有效性的檢測和動物表型檢測。
盡管 DREADDs 技術早已成為研究動物神經元調節(jié)的強有力工具,但由于 CNO 具有較差的腦外顯率,并且通過代謝降解會產生抗精神病藥物氯氮平 (Clozapine),這些特性限制了 DREADDs 技術在臨床醫(yī)學上應用。隨著新技術的不斷涌現,將 DREADDs 技術和正電子發(fā)射計算機斷層顯像技術 (PET) 結合,使 DREADDs 技術在更為廣泛的平臺使用成為現實。
2019 年,美國國立藥物濫用研究所 Jordi Bonaventura 等人的一項研究首次將 PET 技術與 DREADDs 技術相結合。研究團隊開發(fā)出了 3 種新型的 DREADDs 配體 JHU37152、JHU37160 和 [18F]JHU37107。這幾種配體都是 DREADDs 受體的強激動劑,具有出色的大腦滲透能力,并且不會轉化為氯氮平,其中,[18F]JHU37107 放射化學結構最為穩(wěn)定,可以用作特異性的 PET 放射性示蹤劑,在小鼠、大鼠和恒河猴體內對局部定位的神經元及其遠程投射成功地進行了 DREADDs 檢測,從而實現無創(chuàng)性神經元投射標測。DREADDs 技術和 PET 成像技術結合的關鍵在于開發(fā)新型高效的且有穩(wěn)定放射化學結構的 DREADDs 配體。
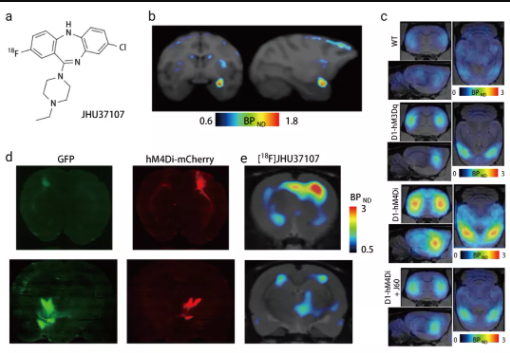
圖 3. PET 放射性配體 [18F]JHU37107 在局部靶向 DREADDs 作用[11]
a. [18F]JHU37107 的結構;b. [18F]JHU37107 與轉基因 D1-DREADD 小鼠大腦中的 DREADDs 結合;c. [18F]JHU37107 與大鼠皮層中表達的 AAV-DREADDs 結合;d. [18F]JHU37107 與猴子杏仁核中表達的 hM4Di 結合。
總結:
GPCRs 參與復雜多樣的細胞信號傳導,是目前最有潛力的藥物靶點之一。然而,GPCRs 的復雜性和多樣性給這些受體的研究帶來了極大的挑戰(zhàn)。DREADDs 技術的出現為人工控制 GPCR 介導的信號轉導和揭示特定生理事件背后的機制提供了強有力的工具。近年,DREADDs 技術與 PET 技術的結合更是擴大了該技術的適用范圍。相信未來 DREADDs 技術還會在更多領域發(fā)揮作用。
在文末留言區(qū)留下您的足跡,受萌 Cece 喜歡的精彩留言,可獲 MCE 神秘周邊一份哦~~
相關產品
Cyclic AMP
細胞內的第二信使,由于某些激素或其它分子信號刺激激活腺苷酸環(huán)化酶。
DREADDs 受體的配體,可以激活 DREADD 受體 hM3Dq 和 hM4Di。
Clozapine
毒蕈堿乙酰膽堿受體 M1 受體的拮抗劑和 M4 受體的激動劑,可用于抗精神分裂癥的研究。
Acetylcholine chloride
一種神經遞質,通過刺激煙堿乙酰膽堿受體,調節(jié)神經元的活性。
收錄了 1400+ 種靶向 GPCRs 的小分子化合物,可以用于 GPCR 相關的不同研究及藥物開發(fā)篩選。
神經信號化合物庫
收錄了 1400+ 種神經信號相關的小分子化合物,可以用于研究神經調控及神經疾病。
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務
Copyright(C) 1998-2024 生物器材網 電話:021-64166852;13621656896 E-mail:[email protected]