藥物機制解讀|“人民的希望”抗病毒藥物瑞德西韋(Remdesivir)
病毒變異vs抗病毒藥物
病毒是一種以DNA或RNA為遺傳物質(zhì),無獨立營養(yǎng)代謝系統(tǒng),需寄生于宿主內(nèi),進行復(fù)制和生存的類生物體。病毒在自然界內(nèi)與宿主共生的過程中,一些病毒可逃脫宿主免疫防御系統(tǒng),導(dǎo)致宿主發(fā)病致死。病毒遺傳物質(zhì)突變幾率非常高,可幫助病毒逃脫不斷升級的宿主免疫系統(tǒng)。根據(jù)病毒進化論學(xué)說,病毒發(fā)展史要遠超過人類進化史,相比之下,人類對病毒知之甚少。隨著分子細胞生物學(xué)的發(fā)展,目前發(fā)現(xiàn)病毒種類7000多種,其中可感染人類的病毒有300多種。病毒感染類疾病占傳染類疾病的3/4,嚴重威脅人類健康。從上個世紀60年代開始,已有廣譜類的抗病毒藥物出現(xiàn),但由于病毒突變速度非�?欤S后陸續(xù)產(chǎn)生病毒耐藥性和副作用,導(dǎo)致對病毒類感染疾病無特異性有效藥物進行臨床治療。
瑞德西韋——人民的希望?
2020年伊始,COVID-2019肆虐,開發(fā)特異性抗新冠病毒藥物迫在眉睫。2月1日《新英格蘭雜志》發(fā)表論文中,報道美國第一例新冠肺炎患者病情惡化后,經(jīng)瑞德西韋(Remdesivir/GS-5734)靜脈注射同情用藥后病情好轉(zhuǎn)[1]。2月6日,瑞德西韋“雙盲臨床實驗”在武漢市金銀潭醫(yī)院、市肺科醫(yī)院和協(xié)和醫(yī)院等入組761例患者進行臨床評價[2]。“人民的希望”——瑞德西韋抗新冠肺炎臨床療效,需等至4月底揭曉謎底。
瑞德西韋是由一直致力于抗病毒領(lǐng)域的吉利德科學(xué)公司研發(fā)(抗流感藥物奧司他韋,商品名達菲,最早也由吉利德研發(fā),后賣給羅氏進行全球銷售)。2013-2016年(西非)和2018-2019年(剛果)埃博拉病毒肆虐期間,全球各大制藥公司擲重金進行抗埃博拉病毒藥物研發(fā)。由美國陸軍傳染病醫(yī)學(xué)研究所,吉利德科學(xué)公司,美國CDC和波士頓大學(xué)醫(yī)學(xué)院四家業(yè)內(nèi)頂級實驗室聯(lián)合進行的瑞德西韋抗埃博拉病毒臨床前藥效學(xué)研究,于2016年發(fā)表在《自然》雜志[3]。
瑞德西韋分子機制——前藥(Prodrug)
三磷酸代謝物有效制止RdRp酶活性
RNA依賴型RNA聚合酶(RNA-dependent RNA-polymerases, RdRp)為廣譜的抗病毒藥物開發(fā)靶點,目前以RdRp為靶點的抗冠狀病毒藥物多為核苷類似物或RNA干擾類[4]。瑞德西韋以前藥(Prodrug)形式進入細胞后,通過三步轉(zhuǎn)化為三磷酸代謝物NTP,NTP和天然ATP競爭結(jié)合病毒RdRp,插入RNA合成鏈中,引起病毒RNA合成終止,并抑制RdRp酶活性(下圖a)[3]。
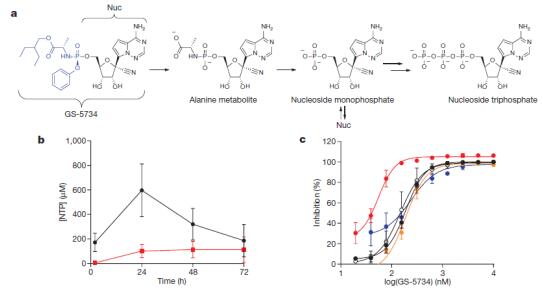
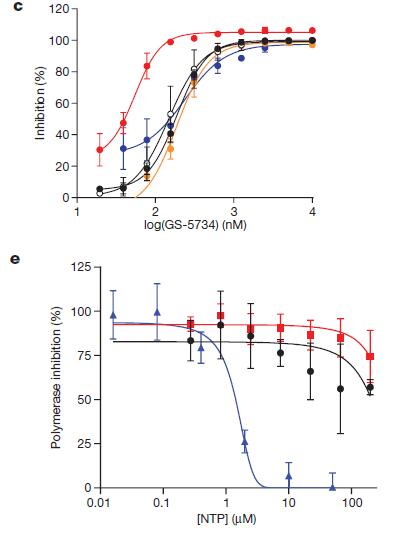
瑞德西韋結(jié)構(gòu)上的1‘-氰基,一方面針對RdRp酶提供更好的針對ATP競爭的結(jié)合活性,另一方面針對病毒RdRp酶提供了比人源RNA聚合酶II和人源線粒體RNA聚合酶(h-mtRNAP)更好的選擇性抑制。在Hela細胞水平,瑞德西韋對兩種埃博拉病毒和另外三種病毒都有顯著濃度依賴型抑制(下圖c);且在分子水平,瑞德西韋活性分子NTP能選擇性抑制病毒RdRp酶活性(下圖e藍色),而對人源RNA聚合酶II(下圖e黑色)和線粒體RNA聚合酶(下圖e紅色)無明顯抑制作用[3]。
瑞德西韋細胞活性——高效選擇性
抑制病毒在細胞內(nèi)復(fù)制
研究人員又通過進一步的細胞學(xué)實驗,分別在不同的細胞模型上評價了瑞德西韋(GS-5734)對埃博拉病毒和其他RNA病毒的抗病毒活性。數(shù)據(jù)顯示,瑞德西韋可在五種細胞模型,包括原代巨噬細胞上有效抑制埃博拉活性;并對呼吸道感染病毒,如RSV和MERS,以及出血熱感染病毒,如JUNV和LASV病毒有一定抑制作用;但對其他病毒如CHIV,VEEV和HIV-1,無明顯抑制(下表)[3]。
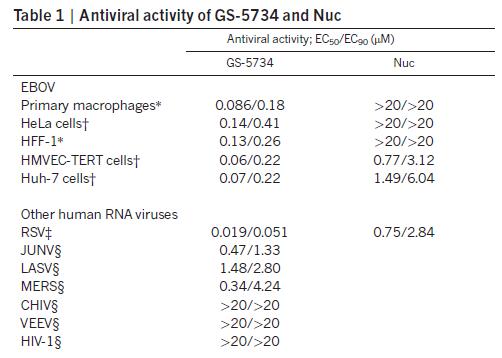
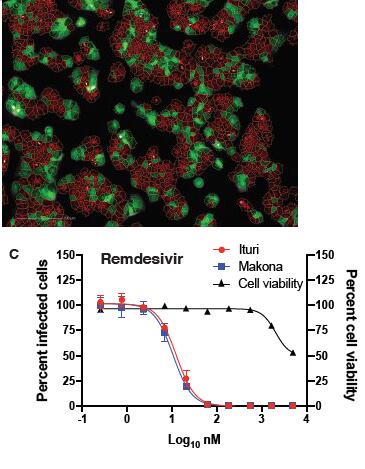
2019年,在《柳葉刀傳染病》雜志報道,美國CDC科研人員建立的Zoanthus綠色熒光蛋白(ZsG)標記的埃博拉病毒體外細胞表型快速評價方法(下圖左),再次驗證了瑞德西韋可在低濃度抑制兩個品系(Ituri/Makona)的埃博拉病毒復(fù)制,并對細胞活性無明顯影響(下圖右)。對Ituri品系埃博拉病毒,EC50為12nm,SI(selectivity index,SI)為303倍;對Makona品系埃博拉病毒,EC50為13nm,SI為279倍[5]。
瑞德西韋體內(nèi)藥效——快速擴散至病灶區(qū),
提高模式動物存活率
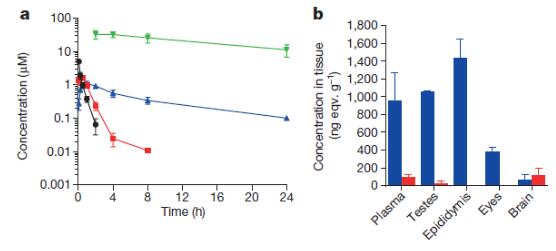
在恒河猴(rhesus monkeys)動物模型上,按10mg/kg計量靜脈注射給藥后,檢測健康恒河猴體內(nèi)瑞德西韋(下圖a黑色) 及其代謝物,丙氨酸代謝物(下圖a紅色), 單磷酸代謝物Nuc(下圖a藍色)和三磷酸代謝物NTP(下圖a綠色),在不同時間點的血藥濃度。數(shù)據(jù)顯示瑞德西韋前藥在體內(nèi)兩個小時內(nèi)達到峰值,隨后很快被清除;而其三磷酸活性代謝物NTP在體內(nèi),特別是外周血單核細胞(PBMCs)內(nèi),可在更長的時間內(nèi)維持高血藥濃度。通過同位素14C標記瑞德西韋藥物后,進一步研究藥物在體內(nèi)分部發(fā)現(xiàn),藥物可快速到達睪丸、附睪、眼睛和腦部(下圖b)[3]。
通過病毒暴露動物模型實驗,瑞德西韋通過靜脈注射給藥后,可顯著提高恒河猴實驗動物的存活率,特別是在病毒暴露3天后按10mg/kg計量的給藥組,其28天后存活率和空白對照組同樣可達100%(下圖d),且通過核酸定量方法進一步驗證,給藥組體內(nèi)的病毒RNA拷貝數(shù)與空白對照組相比得到明顯抑制(下圖e)[3]。

瑞德西韋抗病毒藥物機制總結(jié)
瑞德西韋以RdRp酶為藥物靶點,在廣譜抗病毒核苷類似物抑制劑中脫穎而出,主要歸因于以下三點:1) 對其藥物靶點RdRp酶,比其天然底物ATP有更高的競爭親和性;2)在體外細胞水平,可高效選擇性的抑制RNA病毒在細胞內(nèi)復(fù)制,并無明顯細胞毒性。3)在體內(nèi)動物水平,有良好的藥代學(xué)基礎(chǔ),其活性代謝物NTP可快速擴散至病灶,抑制體內(nèi)RNA復(fù)制,提高病毒暴露后模式動物存活率。
|
試驗方法
|
珀金埃爾默儀器&試劑方案
|
|
RNA聚合酶活性檢測
|
[a-32P]-GTP 同位素標記
|
|
細胞內(nèi)病毒感染評價
|
高內(nèi)涵細胞成像表型分析平臺Opera/Operetta
細胞成像專用微孔板
|
|
抗病毒藥物細胞毒性評價
|
多模式讀板儀 EnVision
|
|
藥物組織分布
|
[14C]GS-5734 同位素標記
同位素液閃計數(shù)儀
|
|
病毒基因組測序分析
|
自動化NGS文庫制備工作站 Sciclone G3
|
抗病毒藥物實驗設(shè)計及儀器&試劑摘錄列表[3,5]
“工欲善其事,必先利其器”。在以上瑞德西韋抗病毒藥物研發(fā)實驗設(shè)計及檢測過程中,珀金埃爾默在每一個環(huán)節(jié)都給一線的科學(xué)家們提供了高效的“實驗武器”:經(jīng)典的同位素標記技術(shù),準確分析RdRp活性和藥物組織分布;業(yè)內(nèi)金標準EnVision多模式讀板儀和高內(nèi)涵成像表型分析平臺Opera/Operetta,快速進行細胞內(nèi)病毒感染和藥物毒性評價;自動化NGS文庫制備工作站Sciclone G3,加速病毒基因組快速分析。

掃描下方二維碼,即可查看珀金埃爾默病毒感染疾病研究整體解決方案。

參考文獻
1.First Case of 2019 Novel Coronavirus in the United States. NEJM Jan 2020.
2.http://www.wuhan.gov.cn/2019_web/whyw/202002/t20200207_304511.html
3.Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. NatureMarch 2016.
4.Coronaviruses — drug discovery and therapeutic options. NATURE REVIEWS DRUG DISCOVERY May 2016
5.Characterisation of infectious Ebola virus from the ongoing outbreak to guide response activities in the Democratic Republic of the Congo: a phylogenetic and in vitro analysis. The Lancet Infectious Diseases July 2019
標簽:
新型冠狀病毒
Copyright(C) 1998-2024 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:[email protected]