改寫經(jīng)典—清華大學(xué)科學(xué)家揭示胰島素信號(hào)通路中調(diào)控糖原合成新機(jī)制
2019年9月24日,清華大學(xué)李蓬課題組在Cell Reports上發(fā)表了題為“The protein phosphatase 1 complex is a direct target of AKT linking insulin signaling to hepatic glycogen deposition”的研究論文,報(bào)道了PP1復(fù)合物作為營(yíng)養(yǎng)感知器,獨(dú)立于GSK3介導(dǎo)胰島素刺激下肝臟糖原合成的調(diào)節(jié)機(jī)制。
胰島素是機(jī)體調(diào)節(jié)血糖吸收、促進(jìn)合成代謝(anabolic metabolism)最關(guān)鍵的激素,可以促進(jìn)糖原、脂肪、蛋白質(zhì)合成。糖原和脂肪可被用于能量貯存;糖原是最先被機(jī)體利用的能量?jī)?chǔ)備:比如在運(yùn)動(dòng)時(shí),肌肉糖原可以作為快速的能量來(lái)源,供肌肉細(xì)胞產(chǎn)生ATP;而肝臟中糖原負(fù)責(zé)在饑餓或能量缺乏時(shí)補(bǔ)充血糖,使之維持穩(wěn)定濃度。但是糖原代謝里一個(gè)長(zhǎng)期懸而未決的問(wèn)題,胰島素是如何激活糖原合成的?甚至在最新版(第七版)的Lehninger生化教科書中,也只是指出需要一個(gè)“insulin-sensitive protein kinase”,但不知其身份。雖然胰島素-AKT可以通過(guò)抑制激酶GSK3、降低糖原合成酶GS磷酸化來(lái)促進(jìn)糖原合成,但是這條調(diào)節(jié)通路的作用非常有限,因?yàn)镚SK3的磷酸化位點(diǎn)突變后不影響糖原合成。并且,GSK3調(diào)控糖原合成是通過(guò)雙抑制作用而起作用,目前我們的認(rèn)識(shí)里還缺乏一種主動(dòng)糖原合成調(diào)控的機(jī)制。雖然已知胰島素還通過(guò)激活磷酸酶PP1,進(jìn)而調(diào)節(jié)多個(gè)關(guān)鍵糖原代謝酶,然而由于對(duì)phosphatase調(diào)節(jié)研究的困難,領(lǐng)域內(nèi)只能猜測(cè)卻難以發(fā)現(xiàn)這個(gè)調(diào)節(jié)PP1磷酸酶的“insulin-sensitive protein kinase”。
PP1(protein phosphatase1)對(duì)糖代謝具有重要作用,參與調(diào)節(jié)多個(gè)糖原代謝酶活性,包括GS、GP和GPK。PP1全酶由一個(gè)催化亞基(PP1c)和一個(gè)調(diào)節(jié)亞基(PPP1R)組成。已知PPP1R3家族作為特殊的一類調(diào)節(jié)亞基可以把PP1靶向到糖原代謝過(guò)程,該家族包括7個(gè)成員,PPP1R3a-g。盡管一些研究表明PPP1R3成員參與調(diào)節(jié)肝臟糖原合成和積累,但是具體的機(jī)制究竟是如何呢?
針對(duì)這個(gè)問(wèn)題,李蓬團(tuán)隊(duì)首先通過(guò)生物信息學(xué)分析磷酸化蛋白組數(shù)據(jù)庫(kù)數(shù)據(jù),找到了10個(gè)候選蛋白,可能是AKT新的磷酸化底物,同時(shí)也參與調(diào)節(jié)糖脂代謝。隨后通過(guò)生化實(shí)驗(yàn)鑒定出PPP1R3g是AKT一個(gè)新的直接底物,同時(shí)結(jié)合質(zhì)譜分析發(fā)現(xiàn)S79是PPP1R3g的AKT磷酸化位點(diǎn)。其后,課題組發(fā)現(xiàn)在胰島素刺激下PPP1R3g可以直接被AKT磷酸化,更重要的是發(fā)現(xiàn)生理和病理?xiàng)l件下的胰島素信號(hào)與PPP1R3g磷酸化水平密切相關(guān)。更進(jìn)一步地,課題組發(fā)現(xiàn)在胰島素刺激下,PPP1R3g介導(dǎo)糖原合成是不依賴于經(jīng)典的GSK3途徑的。接下來(lái),課題組通過(guò)敲除和過(guò)表達(dá)系統(tǒng)在體研究了PPP1R3g磷酸化的生理功能,發(fā)現(xiàn)PPP1R3g磷酸化可以加快葡萄糖清除和提高胰島素敏感性。在機(jī)制上,課題組發(fā)現(xiàn)PPP1R3g磷酸化可以提升與p-GS的結(jié)合,進(jìn)而加快PP1c對(duì)GS的去磷酸化。同時(shí)發(fā)現(xiàn)了PPP1R3b可作為PPP1R3g的下游,通過(guò)結(jié)合從PPP1R3g上解離下來(lái)的去磷酸化GS,刺激糖原的合成,從而實(shí)現(xiàn)對(duì)胰島素信號(hào)的傳遞。
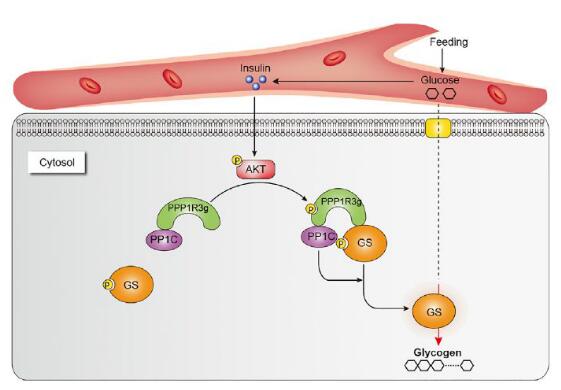
圖1. 胰島素-AKT調(diào)控PPP1R3G磷酸化促進(jìn)糖原合成的新機(jī)制
本研究回答了本領(lǐng)域近30年一直未回答的問(wèn)題,為新版的生物化學(xué)書籍完善提供重要的一筆(圖2)。
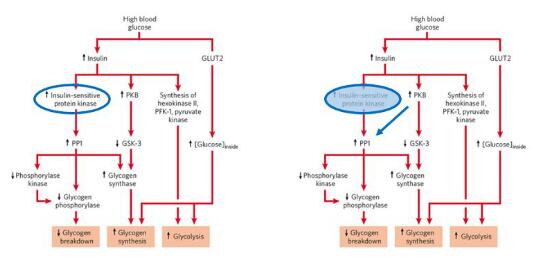
圖2. 經(jīng)典生化教科書中可修改的一筆。左圖為L(zhǎng)ehninger Principles of Biochemistry(7th Edition)中提出的位置激酶,右圖則是該研究提供的改寫
該論文中,糖原合成酶和糖原磷酸化酶活性的研究均采用放射性方法,利用放射性標(biāo)記的葡萄糖作為底物,通過(guò)檢測(cè)放射性活度來(lái)計(jì)算酶的活性。珀金埃爾默提供了從試劑、耗材到檢測(cè)儀器的完整解決方案,助力中國(guó)科學(xué)家取得更大成就。
標(biāo)簽:
胰島素
- 研究進(jìn)展:視頻引導(dǎo)的手持式高速光學(xué)相干層析成像系統(tǒng)
- ULTIMUS 9 LAB小動(dòng)物超分辨超聲成像系統(tǒng)產(chǎn)品技術(shù)應(yīng)用動(dòng)態(tài)
- 利用新型多光譜短波紅外成像評(píng)估人體燒傷創(chuàng)面的深度
- 光學(xué)相干層析成像(OCT)多種焦深拓展策略分析
- 西妥昔單抗標(biāo)記臨床腫瘤樣本對(duì)比近紅外和短波紅外成像效果
- 通過(guò)Au-Se鍵克服金納米顆粒的肝臟生物轉(zhuǎn)化障礙以增強(qiáng)體內(nèi)活性靶向
- 非接觸式短波紅外成像用于閉眼下的動(dòng)態(tài)快速瞳孔測(cè)量和凝視評(píng)估
- 利用短波紅外拉曼散射實(shí)現(xiàn)宏觀無(wú)標(biāo)記的生物醫(yī)學(xué)成像
- 進(jìn)科馳安順利參加第六屆全國(guó)斑馬魚PI大會(huì)
- 博鷺騰動(dòng)物活體成像中標(biāo)土耳其安卡拉大學(xué)醫(yī)學(xué)院
- 博鷺騰國(guó)內(nèi)首家展示中心在深圳醫(yī)學(xué)科學(xué)院盛大揭牌
- 奧龍集團(tuán)攜臺(tái)式μCT等儀器精彩亮相2024上海QC展會(huì)
- 博鷺騰亮相熒光探針發(fā)展與應(yīng)用青年高峰論壇并做報(bào)告
- 益仁恒業(yè)飛依諾小動(dòng)物超聲成像系統(tǒng)成功登陸日本市場(chǎng)
- 羅輯邀您參加中國(guó)微循環(huán)學(xué)會(huì)第11次全國(guó)微循環(huán)大會(huì)
- 祝賀:銳視科技與東華大學(xué)Micro-CT聯(lián)合實(shí)驗(yàn)室成立
Copyright(C) 1998-2024 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com