��(d��ng)ǰλ�� > ���(y��) > ���g(sh��)���� > microRNA�Č�(sh��)�r(sh��)�����o�h(hu��n)RT-PCR���g(sh��)
microRNA��(sh��)�r(sh��)�����o�h(hu��n)RT-PCR���g(sh��)
microRNA��(sh��)�r(sh��)�����o�h(hu��n)RT-PCR���g(sh��)
ժҪ��
���_�l(f��)��һ�N���͵�microRNA��miRNA���Ķ����������������o�h(hu��n)���D(zhu��n)���Taqman PCR�������o�h(hu��n)RT������RT Ч�ʺ��خ��Է���Ȃ��y(t��ng)�ĸ�����TaqMan miRNA�ęz�y(c��)�Ǻܾ��w�ģ����ԙz�y(c��)����miRNA�ͅ^(q��)�����P(gu��n)����������һ��(g��)�������miRNAs����������������(hu��)�ܵ�����MDNA��Ⱦ��Ӱ������_�������ԏĵ���25Ƥ�˵Ŀ�RNA����ȡ�����(sh��)miRNA��
��(sh��)�����@�N�����`���ȸߣ��خ��ԏ�(qi��ng)�;��ܶȸ������S�o(w��)����ἃ����ֱ�ӷ�����(g��)��(x��)����
���(bi��o)��(zh��n)TaqMan������_(d��)������TaqMan miRNA�ęz�y(c��)�@ʾ����7��(g��)��(sh��)����(j��)�Ą�(d��ng)�B(t��i)�������߂�(g��)С��M�����傀(g��)miRNA�����@ʾ����ÿ��(g��)��(x��)���У��е���10�����^(gu��)30000��(g��)��ؐ��(sh��)���@�N�������Դ_����������(zh��n)�_���`��miRNA���_(d��)�V�������R(sh��)�e�ͱO(ji��n)���ض��M�����ĝ��������(bi��o)־�����o�h(hu��n)RT-PCR����������СRNA��������̸ɔ_RNA��siRNAs�������������⣬����õ��خ��Ժ�Ч�����o�h(hu��n)RT�����O(sh��)Ӌ(j��)�ĸ�����ԑ�(y��ng)����С����RNA��¡�Ͷ��ؙz�y(c��)��
���ԣ�
miRNA����Ȼ�l(f��)�������߶ȱ��ص��D(zhu��n)䛼�ͥ����(l��i)Դ���^��İl(f��)�Aǰ�w��miRNA���ڄ�(d��ng)���ֲ��Ļ���M�ϰl(f��)�F(xi��n)������Ŀǰ��ֹ����1000��(g��)��(d��)�ص��D(zhu��n)䛮a(ch��n)������������ɣ������miRNA��ע��(c��)���а���326���miRNA��
miRNA��ͨ�^(gu��)��mRNA�ķ��ѻ�����mRNA�ķ��g��(l��i)�{(di��o)��(ji��)������_(d��)���������J(r��n)���ڼ�(x��)���l(f��)�����ֻ��͂���(d��o)�аl(f��)�]����Ҫ���á����w؟(z��)�����{(di��o)��(ji��)��(x��)����ֳ����ꐴ��x���l(f��)���r(sh��)�g����(x��)����������Ѫ����(j��ng)�l(f��)��������[���γ��cDNA������Ⱦɫ�|(zh��)�����
�mȻmiRNA������(du��)�S�����D(zhu��n)䛮a(ch��n)��e������_(d��)ˮƽ����N�ͽM��֮�g���ܴ��S�ȵ�miRNA��(j��ng)���ӱܙz�y(c��)���g(sh��)�����¡��Northern�s���ͻ���оƬ�������@�����҂����һ�N���͌�(sh��)�r(sh��)�����������܉��(zh��n)�_�`���ؙz�y(c��)miRNA�c����С����RNA���@�N�����U(ku��)չ�ˌ�(sh��)�r(sh��)PCR���g(sh��)���Ĵ���ӵĻ�����_(d��)�����ӵ�׃���z�y(c��)��
���Ϻͷ���
��ɣ�����ĵ�miRNAע��(c��)�W(w��ng)վ �кY�xĿ��(bi��o)�������̽�������TaqMan miRNA�z�y(c��)����ͨ�^(gu��)��(y��ng)������ϵ�y(t��ng)��˾��P / N4365409���õ���miRNA��(bi��o)��(zh��n)TaqMan����������PrimerExpressܛ���O(sh��)Ӌ(j��)PRI-LET-7A-3��PRI-MIR-26B��miRNAǰ�wmiR-30A�������������a(b��)���Y�ϲ��ֿ������ϳ�miRNA�ĹѺ������Integrated DNA Technolo-gies (IDT, Coralville, IA)ُ(g��u)�I��
RNA�ӱ��M������(x��)������(x��)���ѽ���Ϳ�RNA�Ƃ�
��Ambion��˾��P / N7810��7812��7814��7816��7818��7824��7826��7968��ُ(g��u)�I10-12��������X���������������������ѳ�����̥�Ŀ�RNA��Ʒ�� Ambion��˾��Ŀ�RNA��(l��i)����ʿ�f��˹��С��������TaqMan������_(d��)�������С���3 - �������ȩÓ��ø��GAPDH����(n��i)��(du��)�գ�P / N4310884E4352339E����(y��ng)������ϵ�y(t��ng)��˾�����е�RNA��Ʒ�M(j��n)�И�(bi��o)��(zh��n)����
�ɂ�(g��)��(x��)����HepG2��OP9�����B(y��ng)��ʹ��Gibco��˾MEM��P / N 12492-021��Invitrogen��Carlsbad, CA���a(b��)��10��̥ţѪ�壨FBS��(P/N: SH30070.01, HyClone, Logan, UT)���B(y��ng)����Ѫ��Ӌ(j��)��(du��)��ø������(x��)��Ӌ(j��)��(sh��)���s2.8��106��(g��)�Ҹ���(x��)��ͨ�^(gu��)�x�ij�����1500r.p.m.�x��5��犣���1���������� MgCl2 and CaCl2�ĶŠ�ؐ�Ƶ������}���_Һ��PBS��ϴ����
��(x��)���ّҸ���140����PBS���������N��ͬ�Ę�Ʒ�Ƃ䷽��̎������һ�N������һ��(g��)50�����Ęӱ���106��(g��)��(x��)���������ĺ��ἃ���ѽ�Һ��ϣ������ܷ���(f��)����ʮ����Ȼ�����D(zhu��n)�������ӵ�RT����(y��ng)�wϵǰ�����ѽ�Һ��1 U / ml��RNase���Ƅ���Һϡ�1/10���ڵڶ��N����������mirVanamiRNA��ȡԇ������ȡ50�����Ęӱ���106��(g��)��(x��)�����������Ŀ�RNA��100����ϴÓ���_Һ��ϴÓ�������N������1��PBSϡ�1/2��95��ӟ�5������ڼ���RT����(y��ng)�wϵǰ�����ڱ��ϱ�����
��mirVana miRNA�z�y(c��)ԇ���Йz�y(c��)miRNA
����(j��)�����̵ąf(xi��)�h��ʹ��mirVana-miRNA�ęz�y(c��)ԇ���Ќ�(du��)miRNA�s����������IDT�ϳ�RNA̽���������ͬλ�ؘ�(bi��o)ӛ��RNAƬ���Ú����惦(ch��)�ɹ��ϵ�y(t��ng)�M(j��n)�Йz�y(c��)�Ͷ�����
���D(zhu��n)�ø����(y��ng)
���D(zhu��n)䛷���(y��ng)�а�����RNA��Ʒ������������RNA����(x��)���ѽ���͟�̎����(x��)����50�{���o�h(hu��n)RT������1��RT���_Һ��ÿdNTPs���0.25������3.33 U / µL �����D(zhu��n)�ø��0.25 U / µL��RNase���Ƅ���7.5������(y��ng)�wϵ��9700�ض�ѭ�h(hu��n)��96- �� 384-ƽ����16�����B(y��ng)30�����42��30��犣�85��5�����Ȼ��4�����������D(zhu��n)䛷���(y��ng)�������o(w��)ģ�匦(du��)�պ�RTؓ(f��)��(du��)�գ����M(j��n)��һ���؏�(f��)��
PCR
���Ø�(bi��o)��(zh��n)��TaqManPCRԇ�����M(j��n)�Ќ�(sh��)�r(sh��)PCR�� 10��LPCR����(y��ng)�wϵ����0.67��LRT�a(ch��n)����1��TaqMan Mix ��0.2��M��TaqMan̽���1.5m M���������0.7µM��������������(y��ng)�� 384-ƽ�_(t��i)��95�����B(y��ng)10�����95��15��60��1���40��(g��)ѭ�h(hu��n)�����еķ���(y��ng)һʽ������ C T���ڟɹ�ͨ�^(gu��)�̶��ֵ��ѭ�h(hu��n)��(sh��)���ɹⶨ��CTֵ�D(zhu��n)�Q�ɽ^��(du��)��(sh��)���Ŀ�ؐ��(sh��)��ʹ�úϳ���-4 miRNA�Ę�(bi��o)��(zh��n)������
�Y(ji��)��
�҂������һ��(g��)�µ�miRNA�Ķ����Č�(sh��)�r(sh��)RT-PCR���g(sh��)�������������ɂ�(g��)���E��RT�͌�(sh��)�r(sh��)PCR���������o�h(hu��n)RT�������cmiRNA�����s����Ȼ����Multi-Scribe���D(zhu��n)�������(l��i)���Â��y(t��ng)��TaqMan PCR����(du��)RT�a(ch��n)Ʒ�M(j��n)�ж�����
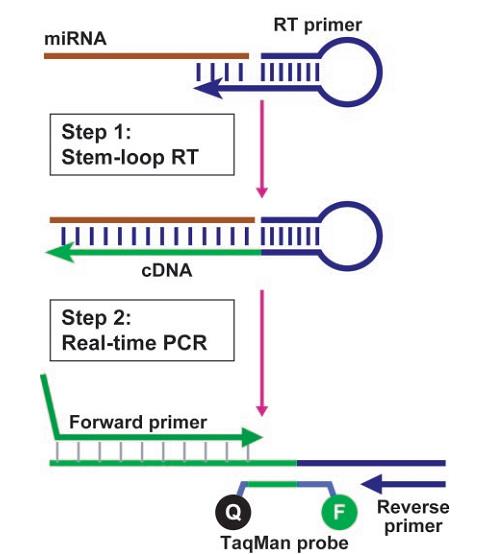
�D1���ψD��������TaqMan miRNA�ęz�y(c��)ԭ��������TaqMan��(sh��)�r(sh��)����miRNA�İ����ɂ�(g��)���E���o�h(hu��n)RT�͌�(sh��)�r(sh��)PCR���o�h(hu��n)RT����Y(ji��)����miRNA���ӵ�3'�˺��÷��D(zhu��n)�ø���D(zhu��n)���Ȼ����RT�a(ch��n)Ʒʹ�Â��y(t��ng)��TaqMan PCR���������а����ض�miRNA������������������Ⱦ�Ϙ�(bi��o)ӛ��TaqMan̽���β��������5'�������Ǹ���(j��)miRNA���ӵ����нM�����������ڜضȣ�Tm����
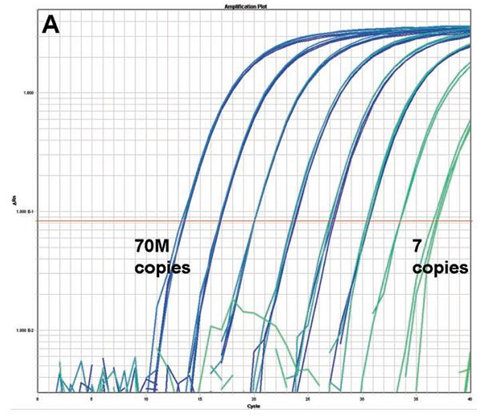
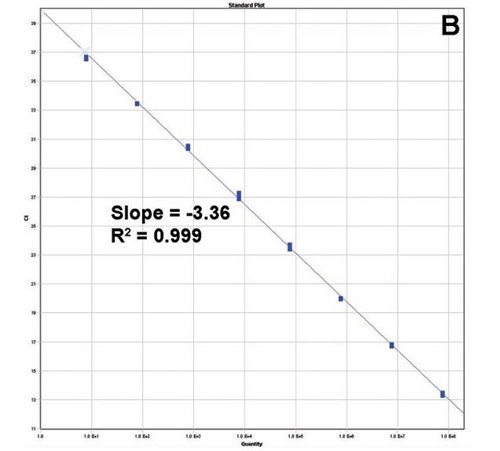
�D2��TaqMan-4 miRNA�ęz�y(c��)�Ą�(d��ng)�B(t��i)�������`���ȡ� ��A��4���^(gu��)7��(g��)��(sh��)����(j��)�� lin-4 miRNA�U(ku��)���������ϳɵ�RNAݔ�뷶����1.3��10��3 fM���ஔ(d��ng)��ÿ�η���(y��ng)7��(g��)��ؐ��(sh��)�� 〜1.3��104 FM���ஔ(d��ng)��ÿ�η���(y��ng)7��107��ؐ��(sh��)������B��lin-4 miRNA�Ę�(bi��o)��(zh��n)������
miRNA�����Ą�(d��ng)�B(t��i)�������`���ȵ�Ӌ(j��)��ʹ��һ�N�˹��ϳɵ�CEL-LIN-4���M(j��n)���״��u(p��ng)�����ϳɵ�RNA�� A26ֵ�Ļ��A(ch��)��������ϡጳ��^(gu��)7��(g��)��(sh��)����(j��)�� CEL-LIN-4 TaqMan miRNA�ęz�y(c��)�Y(ji��)���@ʾ��Ŀ��(bi��o)ݔ���CTֵ֮�g�ИO�õľ����P(gu��n)ϵ��������ԓ�z�y(c��)������7��(g��)��(d��ng)�B(t��i)���������܉�z�y(c��)PCR����(y��ng)������7��(g��)�Ŀ�ؐ��(sh��)���D2����
����С��ο�RNA�İ˂�(g��)�~��miRNA�ęz�y(c��)Ҳ���C��(sh��)��RNA��ݔ�뷶����0.025��250�{�ˣ��D3���� ���P(gu��n)��RNAݔ���TheCT ֵ���^(gu��)4��(g��)��(sh��)����(j��)��R2>0.994������Ԍ�(du��)�ՙz�y(c��)������ʹ��250�{�˿�RNA���(bi��o)�ķ���(y��ng)����CEL-MIR-2�](m��i)�нo��һ��(g��)�z�y(c��)��̖(h��o)��
����(j��)�߂�(g��)��ͬ����M�����傀(g��)miRNA�ı��_(d��)�V�y(c��)������(chu��ng)��һ��(g��)miRNA�ı��_(d��)�D�V��ÿ��(g��)��(x��)���еĿ�ؐ��(sh��)����(j��)ݔ��Ŀ�RNA�����O(sh��)15Ƥ��/��(x��)�����ͺϳ�lin-4Ŀ��(bi��o)�Ę�(bi��o)��(zh��n)����Ӌ(j��)�������@��(g��)���_(d��)�D�V������һЩ��Ȥ���^����������miRNA�dz��S�����M����ÿ��(g��)��(x��)��ƽ����2390��(g��)��ؐ��(sh��)��ÿ��(g��)��(x��)�����_(d��)�Ŀ�ؐ��(sh��)��10-32090֮�g׃���������нM������12��(g��)miRNA����miR-16��miR-323�����S������������_(d��)��miRNA��������ÿ��(g��)�M�����Ъ�(d��)�ص�miRNA�ı��_(d��)ˮƽ��miRNA���_(d��)�����wˮƽ��С�������ߺ���̥��������������7��(g��)�M���У�miRNA���_(d��)�Ą�(d��ng)�B(t��i)����׃���ܴ����IJ���5��(let-7a)�����^(gu��)2000��(miR-323) ����1����
�u(p��ng)��RNA���x����Ҫ���҂�ֱ����miRNA�ęz�y(c��)�������˼�(x��)���ѽ������ஔ(d��ng)��ֱ����7.5�������D(zhu��n)䛷���(y��ng)������2.5-2500��(x��)������(d��ng)�z�y(c��)������һЩ��(x��)����CTֵ���P(gu��n)R2>0.998����RT����(y��ng)����������(g��)��(sh��)����(j��)���D4����
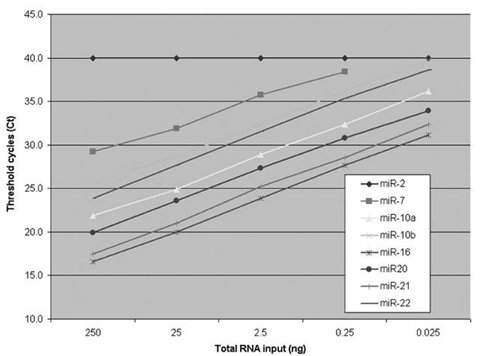
�D3����RNAݔ����ֵѭ�h(hu��n)��CT��ֵ�z�y(c��)8��(g��)miRNA�����P(gu��n)����ÿRT����(y��ng)����С��ο�RNAݔ�뷶����0.025��250�{�������U��x��miRNA��MIR-2������������Ԍ�(du��)�ա�
����˵��X�����������Σ��������ѳ�����̥��10-12�죩�Ŀ�RNA��Ʒ��ُ(g��u)��Ambion��˾������(j��)��(bi��o)��(zh��n)����lin-4�ϳɵ�miRNA��(du��)ÿ��(g��)��(x��)����ؐ��(sh��)�M(j��n)�й�Ӌ(j��)��ÿ��(g��)RT����(y��ng)������150ng��RNA�����ஔ(d��ng)�ڼs10 000��(g��)��(x��)�������O(sh��)ÿ��(g��)��(x��)������15pg��RNA��������(j��)TaqMan�������ȩÓ��ø�ă�(n��i)��(du��)�գ�P / N4352339E����RNAҎ(gu��)����ݔ�롣
�z�y(c��)��12�M���ض��Ļ���MDNA��(du��)TaqMan miRNA��Ӱ����Y(ji��)��������RT����(y��ng)���Ƿ�����5�{�������MDNA��(du��)CTֵ�](m��i)��Ӱ푣�����RNA��Ŀ��(bi��o)����(sh��)��(j��)δ�@ʾ���z�y(c��)�Ƿdz��خ����������@һ�^�����҂�ֱ��miRNA�����z�y(c��)�������˟�̎����(x��)�����D5�@ʾ��ʹ�ü�����RNA����(x��)���ѽ�������ͬ�Ӕ�(sh��)Ŀ��HepG2��(x��)���õ��ğ�̎����(x��)����miRNA�M(j��n)�ж������^��ֱ�����ӟ�̎����(x��)����miRNA�ęz�y(c��)CTֵ��������������N��ͬ�Ę�Ʒ�Ƃ䷽�����ơ�
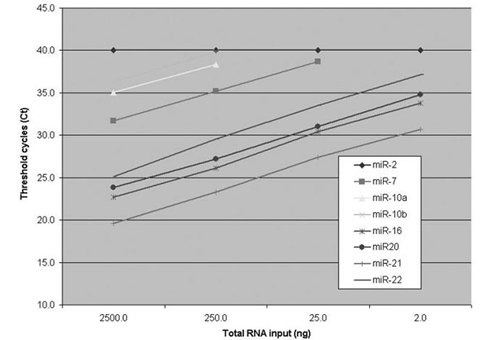
�D4��ʹ��OP9��(x��)���ѽ���z�y(c��)TaqMan miRNA�Ą�(d��ng)�B(t��i)������ ÿ��(g��)RT�wϵ��ݔ�뼚(x��)����(sh��)������3��2500��(g��)��(x��)���������U��xelegans miRNA��MIR-2��������Ԍ�(du��)����

�D5����(du��)��̎����(x��)������(x��)���ѽ�Һ��10 miRNA��(sh��)�r(sh��)������RNA�M(j��n)�б��^�����ֵѭ�h(hu��n)��CT����(l��i)����miRNA�ı��_(d��)ˮƽ��ÿPCR�U(ku��)���s400 HepG2��(x��)���M(j��n)���˷�����
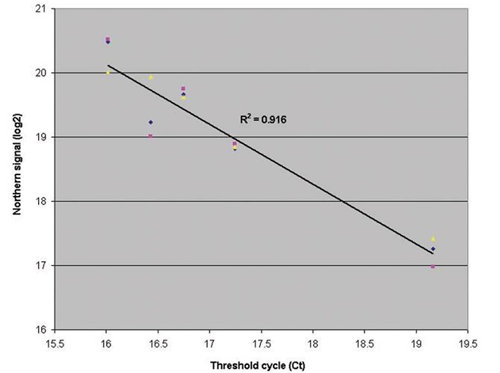
�D6����TaqMan miRNAmiR-16�ķ������^��(l��i)��Q��ӡ�E�s������A(ch��)�ķ�������RNA��(l��i)��С���I�������Σ�Ƣ�ͲG��M����
�Ƀɂ�(g��)��(d��)���\(y��n)��ϵ�y(t��ng)����(sh��)��(j��)δ�@ʾ����(du��)12 miRNA16�؏�(f��)�z�y(c��)TaqMan miRNA�Ŀ��٬F(xi��n)����CT�Ę�(bi��o)��(zh��n)ƫ��ƽ����0.1���@ʾ�z�y(c��)�ĸ߾�����
�҂�����һ��(g��)��(d��)���ļ��g(sh��)���@��(g��)���g(sh��)�ǻ����s��ӡ�E��miRNA���������^TaqMan miRNA�ęz�y(c��)���D6�����҂��^�쵽�s������A(ch��)��miRNA�����؏�(f��)�Բ�ڏ�Ŀ��(bi��o)��Ŀ��(bi��o)��׃���к�TaqMan����һ�����傀(g��)��M���ӱ��е�miR-16�ăɷN������R2= 0.916��һ�¡�Ȼ�����ڵ��S�ȵ�miRNA�����P(gu��n)������(du��)�^������miR-30�ģ�R2= 0.751����
�s���ķ�����(du��)�����miRNA��(l��i)�vȱ���خ������҂��{(di��o)����TaqMan miRNA�^(q��)�ֳ���miRNA���^�L(zh��ng)��ǰ�w�ęz�y(c��)�������ϳ�pri-miRNAǰ�w��pri-miR-26b��pri-let-7a��pre-miRNA ǰ�wpre-miR-30a��Ҋ��2���� TaqMan����ּ�ڙz�y(c��)ǰ�w�ͳ����miRNA�M(j��n)�кϳ�ƽ��1.5��Ŀ��(bi��o)��108��RT����(y��ng)������ÿPCR�wϵ1.3��107��ؐ��(sh��)�����HPRI-miRNAǰ�w���ӵ�TaqMan miRNA�ķ����a(ch��n)�����^�����miRNA�ķ����߳�����11��(g��)ѭ�h(hu��n)��CTֵ���@һ�Y(ji��)����ζ������������miRNA��ǰ�w�ڝ����ͬ�����ߌ��ڙz�y(c��)�����Ŀ��(bi��o)�r(sh��)ؕ�I(xi��n)<0.05���ı�����̖(h��o)����(du��)��pre-miR-30a��(l��i)�v�������miRNA miR-30a-3p��λ����pre-miR-30a����3��ĩ�����^�쵽8.4 CT�IJ���Y(ji��)����������(du��)�ڳ���miRNA��(l��i)�f(shu��)��TaqMan miRNA�ęz�y(c��)���خ��ġ�Ȼ�������miRNAλ��pre-miRNAǰ�w�5'�����خ��Է�����������RNA��(sh��)�(y��n)��������ϳ�Ŀ��(bi��o)��������ǰ�w�c����miRNA����������S����С�ڃɂ�(g��)��(sh��)����(j��)������CT ��miR-26b-1 �� let-7a-2ǰ�w�IJ����7��(g��)��7��(g��)���ϔ�(sh��)����(j��)��һ�����]���@Щ�Y(ji��)����������(du��)�ڳ���miRNA��(l��i)�f(shu��)��TaqMan miRNA�ęz�y(c��)�����خ���

�D7��let-7 miRNA�ęz�y(c��)�b�e��������(du��)�z�y(c��)������Ӌ(j��)���ǻ���CT��ȫƥ��Ͳ�ƥ���Ŀ��(bi��o)֮�g�IJ����RT����(y��ng)�����Ӻϳ�RNA��1.5��108 ��ؐ��(sh��)����Ӌ(j��)�����A260 ֵ�Ļ��A(ch��)�ϡ�
TaqMan miRNA�ęz�y(c��)������ͬ��������(j��)����let-7a, let-7b, let-7c, let-7d ��let-7e 5��(g��)�ϳ�miRNA��(l��i)�z�y(c��)����һ��(g��)�����ᣨ�D7����ÿ��(g��)miRNA�ęz�y(c��)��(du��)��(y��ng)ÿ��(g��)miRNA������(du��)̽�y(c��)Ч����ͨ�^(gu��)Ӌ(j��)��ȫƥ��Ͳ�ƥ���Ŀ��(bi��o)CT֮�g�IJ�����O(sh��)����ƥ���Ч�ʞ�100�����^����خ�����̖(h��o)̎�ڷdz��͵�ˮƽ�����㵽0.3������(du��)��miRNA��2-3��ƥ����0.1-3.7���Ćκ����ͬ���S�ཻ�淴��(y��ng)������RT����(y��ng)����(y��ng)��G-T���e(cu��)�䌧(d��o)�µ������miRNA֮�g���F(xi��n)���^(gu��)����(g��)��ƥ�䣬��(hu��)��ᘌ�(du��)�Ե�miRNA�z�y(c��)��
�҂����^��ҕ��TaqMan miRNA�ęz�y(c��)�����IJ�ͬ���Խ�Q�s����������A(ch��)�ęz�y(c��)���D8�������҂����������s���������Ժܺõ^(q��)��let-7a��let-7b��Ȼ������let-7a, let-7c �� let-7d֮�g�����](m��i)�Ѕ^(q��)�e��������1�C3 nt�^(q��)����
�҂��Ɯy(c��)���o�h(hu��n)������ܕ�(hu��)�Ⱦ��������ṩ���õ�RTЧ�ʺ��خ��ԡ�����(j��)�o�h(hu��n)�Ķѷſ��ܼӏ�(qi��ng)RNA-DNA�ğ᷀(w��n)�������������c���y(t��ng)�ľ���RT�������o�h(hu��n)�Ŀ��g�s�����ܕ�(hu��)��ߙz�y(c��)���خ��ԡ��҂����^���o�h(hu��n)�;���RT����ϳ�miRNA let-7a���`���Ⱥ��خ���(�D 9)���҂��^�쵽���o�h(hu��n)RT�ׂ�(g��)��(y��u)��(sh��)�����ȣ��ںϳ�let-7AĿ��(bi��o)�r(sh��)�����Ժ��o�h(hu��n)RT����CTֵ��7��(g��)��(sh��)����(j��)��ͬ�������o�h(hu��n)RT��Ч�ʸ߳�����100����������o�h(hu��n)RT�څ^(q��)��miRNA֮�g��ͬ�r(sh��)���ǻ��ڦ�CTֵ�ɂ�(g��)ԭ�t�IJ�ͬ���������(j��)7��(g��)��(sh��)����(j��)��CT����(du��)�څ^(q��)�ֳ����miRNA����ǰ�w���o�h(hu��n)RT���ٺ�100����
ӑՓ
����miRNA�İl(f��)�F(xi��n)���@Щ���������������@���M(j��n)չ�ѽ�(j��ng)���L�˻����{(di��o)����miRNA���ܵęC(j��)������ˣ��R(sh��)�emiRNA�������(bi��o)ӛ�ض��ĽM����ͻ���B(t��i)�ďV�����о��ѽ�(j��ng)�_ʼ���@Щ�о�����(hu��)������miRNA��(zh��n)�_�R(sh��)�e������������
��(d��ng)ǰ�z�y(c��)������miR-NAs�ķ�����Ҫ���ڿ�¡��Northern�s�����������������M��оƬ�������miRNA�V�Įa(ch��n)����ԓ�������`���Ⱥ��خ��Է�������������(du��)�ľ����ԡ���(du��)��miRNA�Ķ������`���ȵ��ѳɞ�һ��(g��)�Ć�(w��n)�}����?y��n)���y�Ŵ��@Щ�̵�RNAĿ��(bi��o)Ƭ�Ρ��������خ��Ե������ܕ�(hu��)��(d��o)���������P(gu��n)��miRNA��ǰ�w�ͻ���M���е��e(cu��)�`�ķe�O��̖(h��o)��������ш�(b��o)����ᘌ�(du��)miRNA�������ĺ�����u��z�y(c��)��Ȼ�������u��z�y(c��)�خ��Ժ�������������ÿ�z�y(c��)������Ҫ50 ng��RNA����1000�ѽ⼚(x��)����
��(sh��)�r(sh��)PCR�ǻ�����_(d��)�Ķ����Ľ��(bi��o)��(zh��n)����(du��)�ڿƌW(xu��)�ҁ�(l��i)�f(shu��)���O(sh��)Ӌ(j��)��Ҏ(gu��)PCR���z�y(c��)ƽ��22��(g��)�������L(zh��ng)�ȵ�miRNA��һֱ��һ�N�L(zh��ng)������(zh��n)��(l��i)���҂��_�l(f��)��һ�N�µęC(j��)�Ɓ�(l��i)�O(sh��)Ӌ(j��)TaqManPCR����(y��ng)�z�y(c��)���ó��^(gu��)�F(xi��n)�еij�Ҏ(gu��)�z�y(c��)�����ă�(y��u)Խ�����܁�(l��i)�خ�����miRNA�ı��_(d��)ˮƽ���҂�?c��)O(sh��)Ӌ(j��)���(y��n)�C�z�y(c��)��222��(g��)�˵�miRNA���@Щ������Y(ji��)����PCR���g(sh��)��տ���`��������(sh��)�r(sh��)�O(ji��n)��(d��ng)�B(t��i)������TaqMan������(b��o)�����������خ��������҂������У��c����miRNA�����miRNAǰ�w��Ч�����ٲ�2000�������ڌ�(du��)��ǰ�w�����MDNA�@Щ�z�y(c��)�Dz����е����҂�����ֱ�����ӟ�̎����(x��)���z�y(c��)�������˘�Ʒ�Ƃ����Ҫ����(du��)�ڳ����miRNA����ǰ�w�ęz�y(c��)����Ҫ�����Â��y(t��ng)��TaqMan��������(l��i)�خ��ؙz�y(c��)ǰ�w��
�҂��^�쵽���ډA���ѷe�Ϳ��g�s�����o�h(hu��n)�Y(ji��)��(g��u)���o�h(hu��n)RT����Ȃ��y(t��ng)�ľ��������и��õ��خ��Ժ������ԣ��D9�����A���ѷe�Կ�����ߟ᷀(w��n)�����������L(zh��ng)��Ч��RT����/ RNA�p������������Ҫ����(du��)�^�̵����D(zhu��n)������(l��i)���RT����Ч�����o�h(hu��n)�Y(ji��)��(g��u)�Ŀ��g���ƣ����Է�ֹ�Y(ji��)�ϻ���M�p�DNA�������RNA��Ʒ�Ƃ������TaqMan miRNA����Ҫ�����ڵ��o�h(hu��n)RT������Ԟ����RT����(y��ng)��С����RNA��¡�����ṩ���õ�Ч�ʺ��خ�����
��(du��)�����wmiRNA�V��һ��(g��)���е����خ���������������Ч���{(di��o)��miRNA���������ܕ�(hu��)��(d��o)��miRNA�������(bi��o)־�R����M���خ��Եİl(f��)�F(xi��n)���Լ�����������miRNA����{(di��o)��(ji��)�ɼ�(x��)���ֻ����҂����o�h(hu��n)RT-PCR���������Ԟ��@Щ�о��ṩ��һ��(g��)�Ќ�(sh��)���еĽ�Q�k�����҂�Ŀǰ�����_�l(f��)�����k����Ҫ�M(j��n)һ������@�N������Ч�á�
��(bi��o)����
microRNA ��(sh��)�r(sh��)���� �o�h(hu��n) RT-PCR
- �ʳ�����������Ϣ���c�c���g�������
- ������(y��ng)�ã������f(xi��)ͬ�{(di��o)��(ji��)ʮ��������x�����c���װY
- �����о���AD����ˎGV-971��Ό�(du��)�Y����������
- CosMx SMI��ʾ��ͯ�ڼt���ǯ��I�����I�K���|(zh��)�c����(r��n)����(x��)���Ļ���
- ����W(xu��)�ҵęC(j��)���W(xu��)��(x��)�����g(sh��)�Z(y��)�ͻ������̽�B
- CNVkit����Ԕ�⣺�Ⱥ�(ji��n)�ֿ�ؙz�y(c��)���@�ӿ�ؐ��(sh��)׃��
- GeoMx DSP���g(sh��)��������(j��)�ܰͽY(ji��)��(g��u)��TLS���о�
- ���װY���[�������g��M�W(xu��)������׃Ƥ�w���W(xu��)�о�
- �����t(y��)ˎ�z�y(c��)�cԇ������(y��ng)������������ȫ��(gu��)��ļ��(j��ng)�N��
- �����n�̣��i�c���ڠ���c���w�o(w��)�Ĵ��x����(zh��ng)
- һ��ֱ�������Ե���ͨ�^(gu��)�����c������Ⱥ�������
- SBC&ģ������2024���һ������ٳ���(j��)��Ӗ(x��n)����Ո(q��ng)��
- SBC��������2024���g��S�M�W(xu��)��(chu��ng)���D(zhu��n)����ӑ��(hu��)
- ��ɭ�Ƴ���ɫȫ������(sh��)��(j��)��������(w��)
- 2024ȫ���L�V�W(xu��)�ù��_�n����Ѫ�ܼ����о����}�v��
- SBC�������CosMx™ SMI���gԭλ���ӳ��������(sh��)�(y��n)
Copyright(C) 1998-2024 �������ľW(w��ng) �Ԓ��021-64166852;13621656896 E-mail��[email protected]