ESI Q-TOF質譜分析PEG化蛋白藥物方法簡介
-- 賈偉 沃特世科技(上海)有限公司實驗中心
PEG修飾蛋白及多肽類藥物后,可在不產(chǎn)生毒性、不損害藥效的情況下,通過增加蛋白類藥物的溶解性、減少免疫原性、增加穩(wěn)定性、延長體內藥物半衰期等功效增強大分子藥物的療效。PEG的這種功效在1970年代后期被發(fā)現(xiàn),到了1990年PEG化修飾的Adagen被美國FDA批準,至今已有若干個PEG修飾的大分子藥物上市銷售,這些藥物在癌癥、肝炎、痛風、糖尿病等疾病治療中為患者帶來了福音。
明確PEG修飾位點、確定修飾位點的數(shù)量、以及表征PEG的聚合度分布性是PEG化大分子藥物運用于臨床前以及藥品質量監(jiān)控必須且非常重要的工作。由于PEG的高分子聚合物性質,由PEG修飾后的蛋白及多肽的結構變得極為復雜。在早期對其進行質譜分析,特別是對PEG的聚合度分布性分析方面,多使用MALDI離子源類型的質譜。這是因為MALDI源離子化的樣品,所帶電荷數(shù)較少(單電荷離子居多),因此其質譜圖相對簡單;而通過ESI源離子化的樣品將攜帶多個電荷,這使離子信號復雜,致使其質譜圖譜較難解析。隨著LC-ESI技術的發(fā)展, 美國Indiana大學的Lihua Huang等學者通過在色譜分析柱后加胺的技術,使樣品的ESI離子化時的荷電數(shù)適當減少,從而使PEG化樣品的ESI圖譜得到高效的解析[1]。而MALDI TOF類質譜由于質譜分辨率的限制(目前MALDI TOF分辨率在8萬內),面對分子量動輒十幾萬甚至更高的PEG化蛋白,其可獲得的數(shù)據(jù)質量較差,因而MALDI方法可得到的PEG化蛋白的有效結構信息非常有限。
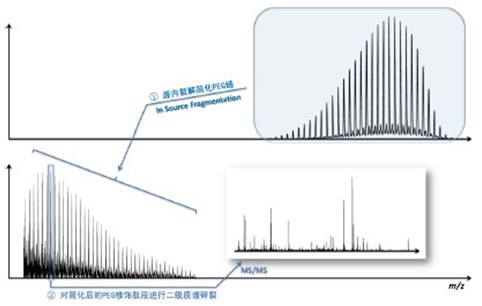
Lihua Huang等學者進一步開發(fā)了ESI Q-TOF分析PEG化蛋白的修飾位點的質譜方法[2]。這種方法包括源內裂解(ISF,In Source Fragmentation)與二級質譜(MS/MS)兩個步驟。在第一步ISF過程中,PEG化多肽的PEG部分被裂解而變短;在第二步MS/MS過程中,多肽被打碎產(chǎn)生b、y離子碎片。通過分析攜帶縮短的PEG鏈的b、y離子信息,最終得出確切的PEG化修飾位點。ISF與MS/MS為什么可以分別 “選擇”碎裂PEG化多肽的PEG與多肽兩個部分呢?推測與PEG化多肽的電荷分布有關。在PEG化多肽的離子化過程中,PEG的醚鍵附著了大量的H+,并在ISF下完全斷裂,而使冗長的P EG鏈縮短到一兩個單位大小。之后的MS/MS過程中,由于縮短的PEG鏈已無H+附著不再斷裂。而多肽在MS/MS中獲得了碎裂的機會,并產(chǎn)生攜帶“PEG短標簽”的b、y離子碎片。論文中,研究人員運用此方法成功地分析了IgG4與胰高血糖素的PEG修飾位點。
參考文獻
(1) Huang L, Gough PC, Defelippis MR. Characterization of Poly(ethylene glycol) and PEGylated Products by LC/MS with Postcolumn Addition of Amines. Anal Chem. 2009, 81, 567-577.
(2) Lu X, Gough PC, DeFelippis MR, Huang L. Elucidation of PEGylation site with a combined approach of in-source fragmentation and CID MS/MS. J Am Soc Mass Spectrom. 2010, 21, 810-818
Copyright(C) 1998-2024 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:[email protected]