電轉(zhuǎn)儀助力CRISPR編輯iPSC新進展:首次報告協(xié)同基因編輯效應(yīng)

2006年,日本科學(xué)家山中伸彌(Shinya Yamanaka)教授利用逆轉(zhuǎn)錄病毒將4個轉(zhuǎn)錄因子轉(zhuǎn)入成體細胞,將其轉(zhuǎn)變?yōu)檎T導(dǎo)多能干細胞(induced pluripotent stem cells, iPSC)。從此后,誘導(dǎo)多潛能干細胞研究領(lǐng)域取得了極大進步,被用于研究人類疾病,目前已經(jīng)有多項研究進入到臨床實驗階段。CRISPR/Cas9基因編輯系統(tǒng)已成為目前最常使用的基因編輯工具,在基因組中生成靶向DNA雙鏈斷裂(Double strand breaks, DSBs),再通過內(nèi)源性細胞DNA DSB修復(fù)途徑進行修復(fù)。將CRISPR技術(shù)與iPSC技術(shù)結(jié)合,將模擬疾病發(fā)生的突變引入iPSC,或修復(fù)iPSC疾病模型中的突變, 再分化得到所需要的特定細胞進行研究或疾病治療,是目前iPSC研究和轉(zhuǎn)化領(lǐng)域的熱點。
目前,基于CRISPR/Cas9技術(shù)在靶向區(qū)域形成DNA雙鏈斷裂(DSB),利用非同源末端連接(Non-Homologous End Joining , NHEJ)方法導(dǎo)致插入和缺失突變,而微同源性末端連接(Microhomology-Mediated end Joining, MMEJ)則導(dǎo)致可預(yù)測缺失。NHEJ和MMEJ統(tǒng)稱為誘變末端連接(Mutagenic End Joining,MutEJ),兩種修復(fù)結(jié)果均可導(dǎo)致DNA序列的丟失或增加。與定制修復(fù)模板如供體質(zhì)粒或單鏈供體寡核苷酸(Single-stranded donor oligonucleotide,ssODN)結(jié)合,利用同源定向修復(fù)(Homology-directed repair, HDR)途徑可實現(xiàn)單核苷酸改變。然而基因精確敲入效率低下和適用性有限,需要采用定制ssODN模板進行優(yōu)化HDR編輯效率。
HDR方式是復(fù)雜而精確的,需要同源序列模板,只能發(fā)生在細胞G2/S期。NHEJ方式是快速非精確的,過程中可能會隨機的引入和去除幾個堿基,整個細胞周期都有活躍發(fā)生的。有多種策略來提高HDR率,如單獨控制DNA修復(fù),細胞周期進程或核酸酶試劑和同源修復(fù)模板可用性,但迄今尚無明確證據(jù)表明這些策略的協(xié)同效應(yīng)。
日本京都大學(xué)iPS細胞研究所的科學(xué)家最新研究表明(Nature Communications,2020),DNA DSB修復(fù)與細胞周期之間有協(xié)同作用,有利于ssOND介導(dǎo)的單核苷酸基因編輯。在iPS細胞中建立了基于GFP到BFP轉(zhuǎn)化的熒光DNA修復(fù)測定方法,可視化定量單等位基因和雙等位基因靶向過程中DNA修復(fù)結(jié)果的頻率。研究發(fā)現(xiàn),通過特定培養(yǎng)條件和小分子調(diào)節(jié)DNA修復(fù)和細胞周期,可協(xié)同增強同源性定向修復(fù)(HDR)的頻率。但是,高頻HDR編輯主要導(dǎo)致雙等位基因報告基因系統(tǒng)中純合突變體的產(chǎn)生,為了在這些條件下生產(chǎn)雜合突變體,這個團隊采用了使用混合ssODN修復(fù)模板的策略,來保護具有沉默突變的一個等位基因。在內(nèi)源性常染色體位點應(yīng)用此協(xié)同基因編輯策略,與基線HDR水平相比,精確編輯生成的雜合和純合突變提高了幾倍。
考慮到基因編輯的iPS細胞在細胞治療中應(yīng)用,采用符合GMP標(biāo)準(zhǔn)的Maxcyte電轉(zhuǎn)儀測試設(shè)定的實驗條件,比較正常培養(yǎng),冷休克,冷休克和N+S條件下DNA修復(fù)結(jié)果頻率,在兩種不同供體遺傳背景下產(chǎn)生雜合和純合GFP iPS細胞系。利用Maxcyte電轉(zhuǎn)技術(shù),在冷休克條件下,結(jié)合XL413和N+S處理,在雜合GFP iPS細胞的單等位基因編輯過程中,同源性定向修復(fù)(HDR)結(jié)果達到83.3%,在純合GFP iPS細胞的雙等位基因編輯中,HDR結(jié)果達到了96.6%。此外,當(dāng)采用混合ssODN M和B修復(fù)模板編輯純合GFP iPS細胞時,獲得了32.2%的復(fù)合雜合子。實驗人員由此得出,協(xié)同基因編輯導(dǎo)致所有目標(biāo)基因座上HDR頻率提高了幾倍,證實了該策略在靶向人類基因組方面的廣泛適用性。
5個基因座(KCNH2 N588D/N588K, APRT M136T, HES7 R25W and PSMB8 G201V)上,在XL+N+S處理下32個克隆中獲得18-23個具有HDR等位基因(56%-72% 總HDR效率)。與N+S聯(lián)用時,XL413引起的細胞周期停滯對HDR率的影響強于冷休克處理。其他5個基因座(KCNE1 D85N, KCNH2 N45D, SCN5A A1428S, and KCNJ11 T293N/T294M)的編輯效率低由于gRNA活性低。
總之,這些結(jié)果證實了,在不同電轉(zhuǎn)儀器和iPS細胞系間,通過細胞周期同步和DNA修復(fù)途徑調(diào)節(jié)的協(xié)同基因編輯可有效地產(chǎn)生純合和復(fù)合雜合突變克隆。參考圖1
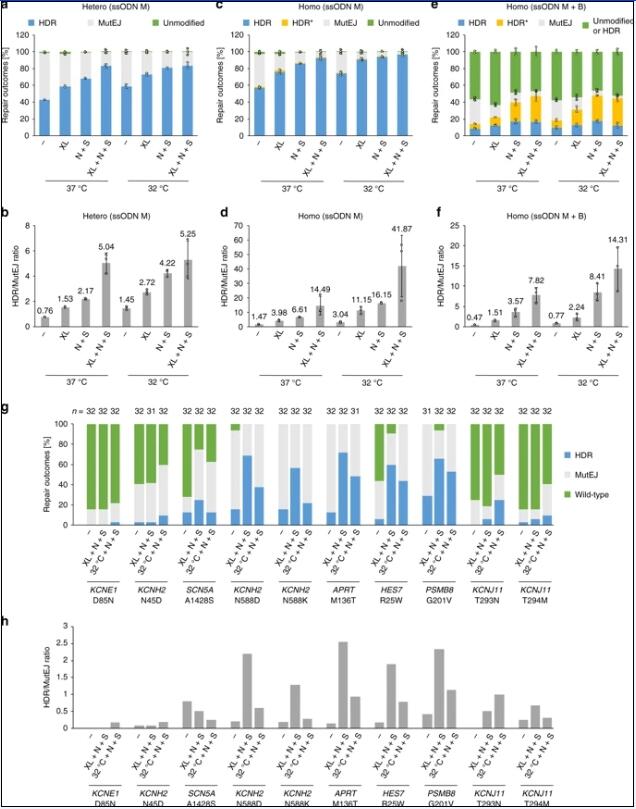
圖1
研究結(jié)論及意義
研究人員采用化學(xué)和細胞培養(yǎng)條件干預(yù)措施,在人iPS細胞ssODN介導(dǎo)的基因編輯過程中,試圖使DNA修復(fù)結(jié)果偏向于HDR。冷休克已被證明在低溫下對細胞功能有多種影響,例如細胞代謝減慢,凋亡途徑激活,基因表達改變和細胞周期停滯�;蚓庉媽嶒炛校湫菘丝商岣逪DR效率,但其機制仍不清楚。本研究表明冷休克可減慢細胞周期進程,使細胞處于G2/M期累積,并降低DNA合成速率。另外,冷休克可通過其他細胞周期依賴的效應(yīng)來表現(xiàn),如核酸酶穩(wěn)定性、gRNA結(jié)合或DNA裂解動力學(xué)和修復(fù)中間體的穩(wěn)定性,翻譯后調(diào)控和細胞活力。參考圖2
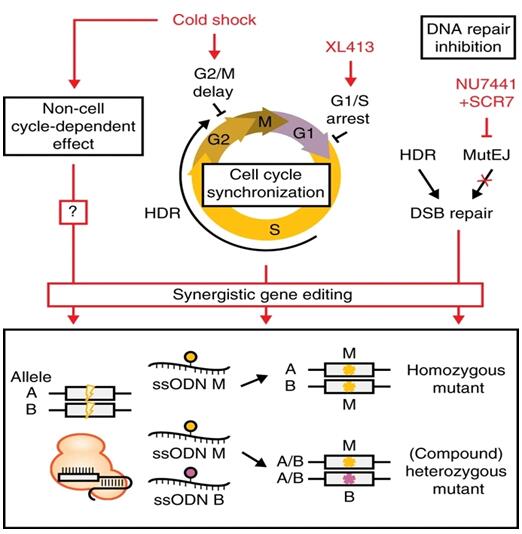
圖2
細胞周期調(diào)節(jié)是DNA修復(fù)和基因編輯領(lǐng)域中持續(xù)不斷的研究課題。本研究報道了在iPS細胞中CDC7抑制劑XL413可增強基因編輯。XL413在癌細胞系中在S/G2/M期積聚細胞,在核型正常細胞中阻滯在G1/早S期,與iPS細胞中觀察一致的。
研究人員發(fā)現(xiàn),NHEJ抑制劑NU7441和SCR7分別提高了iPS細胞中HDR效率,聯(lián)合使用時,進一步提高了HDR效率。DNA-PKcs在DSB形成后被特異性激活,并募集NHEJ途徑的蛋白組分,包括可連接DNA末端的DNA連接酶IV。作者懷疑利用NU7441抑制DNA-PKcs可能會繞過NHEJ復(fù)雜的裝配,并允許選擇其他替代DNA修復(fù)途徑,而對于下游利用SCR7抑制DNA連接酶IV,細胞可能已經(jīng)致力于利用NHEJ或其他替代MutEJ修復(fù)。這可能解釋,與SCR7處理相比,NU7441具有更高的HDR效率。研究人員第一次報告細胞周期同步和DNA修復(fù)途徑調(diào)節(jié)對精確基因編輯有協(xié)同影響。
使用本研究的方法,在不同電轉(zhuǎn)平臺間,協(xié)同基因編輯作用結(jié)果相似的。在純合GFP iPS細胞的雙等位基因編輯中,與NEPA Gene電轉(zhuǎn)儀HDR 48.9%比,Maxcyte具有更高的效率,HDR結(jié)果達到了96.6%, 編輯效率高了2倍。與以前報道一致,通過精確地單等位基因編輯形成的單個HDR等位基因主要與第二等位基因中插入缺失配對。因此,采用混合ssODN策略來創(chuàng)建可防止Cas9再裂解的復(fù)合雜合突變等位基因,當(dāng)采用混合ssODN M和B修復(fù)模板編輯純合GFP iPS細胞時,Maxcyte獲得的復(fù)合雜合子比NEPA Gene高了2.9倍(32.2% vs 11.2%)�?紤]到基因模型的內(nèi)源性靶標(biāo),在多個基因座上實驗產(chǎn)生純合和復(fù)合雜合突變,結(jié)果證明協(xié)同基因編輯始終將HDR結(jié)果頻率提高到基線HDR水平的幾倍。
總之,研究人員建立了一個雙等位基因報告系統(tǒng),該系統(tǒng)能夠解決特定的等位基因DNA修復(fù)結(jié)果,并定義了協(xié)同基因編輯條件,可使用冷休克,細胞周期同步和DNA修復(fù)調(diào)節(jié)來提高HDR和HDR/MutEJ比率。利用高效的雙等位基因修飾方式,展示了產(chǎn)生復(fù)合雜合iPS細胞系的策略。根據(jù)研究結(jié)果可預(yù)測,提高雙等位基因編輯結(jié)果的可靠性將極大地促進顯性和隱性遺傳疾病模型的產(chǎn)生,結(jié)合符合GMP標(biāo)準(zhǔn)的轉(zhuǎn)染技術(shù),甚至可能促進使用人iPSC細胞療法的臨床開發(fā)。
參考文獻:
Thomas L. Maurissen & Knut Woltjen. Synergistic gene editing in human iPS cells via cell cycle and DNA repair modulation. Nature Communications. 08 June 2020
Author:Department of Life Science Frontiers, Center for iPS Cell Research and Application (CiRA), Kyoto University, Kyoto, 606-8507, Japan
關(guān)于Maxcyte公司
Maxcyte是一家臨床階段細胞免疫治療和生命科學(xué)公司,是細胞療法領(lǐng)域早期的先驅(qū)公司之一,總部位于美國馬里蘭州蓋瑟斯堡。作為一家全球運營的生物科技公司,利用專利性的非病毒細胞工程平臺,即流式電轉(zhuǎn)技術(shù)平臺,為全球生物醫(yī)藥行業(yè)的合作伙伴賦能,幫助客戶開發(fā)創(chuàng)新性的細胞療法,來滿足病人對先進細胞療法的需求。利用Maxcyte ExPERT電轉(zhuǎn)平臺結(jié)合基因編輯手段安全高效可高度重復(fù)地對人體原代細胞進行遺傳改造,在符合臨床使用的嚴(yán)格標(biāo)準(zhǔn)前提下,用于治療遺傳性疾病和癌癥。Maxcyte具有全球技術(shù)支持網(wǎng)絡(luò),目標(biāo)是幫助合作伙伴釋放它們產(chǎn)品的所有潛能。
Maxcyte已被全球范圍內(nèi)用戶認可,全球前十制藥公司都采用Maxcyte技術(shù)平臺進行藥物研發(fā),歐美主要基因編輯和細胞治療公司與Maxcyte合作進行新型的基因和細胞治療產(chǎn)品開發(fā),如Allogene therapeutics,Editas medicine,CRISPR Therapeutics,Precision biosciences和Kite pharma等。多個頂級學(xué)術(shù)研究機構(gòu)采用Maxcyte技術(shù)研究哺乳動物細胞和干細胞,如日本京都大學(xué)iPS細胞研究所(CIRA)和美國賓夕法尼亞大學(xué)。
更多產(chǎn)品及技術(shù)信息,請聯(lián)系Maxcyte中國總代理冷泉港生物科技股份有限公司
楊旭輝
微信:qs920409
手機:+86-18518673041
標(biāo)簽:
CRISPR/Cas9 基因編輯 iPSC
- 人端粒酶反轉(zhuǎn)錄酶基因電轉(zhuǎn)染大鼠前軟骨干細胞
- 水牛精原干細胞電轉(zhuǎn)染條件優(yōu)化研究
- siRNA 反向轉(zhuǎn)染技術(shù)提高原代懸浮細胞轉(zhuǎn)染率的方法
- 脂質(zhì)體介導(dǎo)法在提高體細胞轉(zhuǎn)染率方面的應(yīng)用
- 多種轉(zhuǎn)染方法對牛體細胞轉(zhuǎn)染效率的影響
- 鹽酸丁卡因經(jīng)皮滲透電穿孔技術(shù)的關(guān)鍵作用
- 樹突狀細胞電轉(zhuǎn)染影響因素與優(yōu)化條件的深度解析
- 探索未知電穿孔技術(shù)在轉(zhuǎn)基因和動物克隆中的應(yīng)用
Copyright(C) 1998-2024 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:[email protected]