溫度依賴的hERG 通道藥理學(xué)與動(dòng)力學(xué)特性
溫度依賴的hERG 通道藥理學(xué)與動(dòng)力學(xué)特性
簡介
hERG (human ether-a go-go-related gene) 基因編碼的延遲整流鉀通道在哺乳動(dòng)物和人的心肌細(xì)胞動(dòng)作電位的控制中起著至關(guān)重要的作用。多種類型的化學(xué)治療藥物存在潛在的hERG 通道阻斷風(fēng)險(xiǎn),可能引起心電圖上QT間期的延長。這可能導(dǎo)致嚴(yán)重的致死性室性心律失常——尖端扭轉(zhuǎn)型室性心動(dòng)過速(torsade de pointes, TdP)。TdP 風(fēng)險(xiǎn)是管理機(jī)構(gòu)和制藥公司從市場將藥物撤出的主要原因之一(Trudeau, M. C. 1995, Sanguinetti M. C.1995)。
膜片鉗技術(shù)是體外化合物hERG 抑制效應(yīng)評價(jià)的金標(biāo)準(zhǔn)。盡管在技術(shù)層面難度增加,但接近生理溫度條件下的膜片鉗記錄相比于室溫條件下更適合于藥物安全性評價(jià)實(shí)驗(yàn),原因在于溫度依賴性進(jìn)程變化對穩(wěn)態(tài)hERG 通道的抑制有重要影響。已發(fā)表數(shù)據(jù)表明,溫度增加能加速hERG 的激活、失活、失活后恢復(fù)和去激活的動(dòng)力學(xué)變化,以及穩(wěn)態(tài)水平的抑制(Zhou, Z.1998)。其它研究也證明了一些化合物表現(xiàn)出明顯的溫度敏感性以及生理溫度下顯著的效能曲線移動(dòng)(Sale, H. 2008, Kirsch, G. E, 2004)。因此在生理溫度條件下開展功能性hERG篩選是有必要的。相比于傳統(tǒng)手動(dòng)膜片鉗,全自動(dòng)膜片鉗系統(tǒng)實(shí)現(xiàn)更高的通量、耗費(fèi)更少的人力資源,在早期功能性hERG 篩選方面開展更多工作。然而,第一代進(jìn)入市場的全自動(dòng)膜片鉗系統(tǒng)只能進(jìn)行室溫條件下的篩選。
為滿足這樣的需求,IonFlux 系統(tǒng)配置溫度控制模塊,使得用戶可以運(yùn)行溫度依賴性的電生理篩選。在本片文章中,我們展示了hERG 通道的藥理學(xué)和動(dòng)力學(xué)特性,比較了IonFlux 平臺(tái)記錄的室溫條件與生理溫度條件的結(jié)果。

材料和方法
監(jiān)控溫度平衡
溫度改變可以通過細(xì)胞添加前孔電阻變化的測量進(jìn)行監(jiān)控。緩沖液的電導(dǎo)是溫度依賴性的且隨著溫度的升高而增加。圖2 顯示了孔電阻測量結(jié)果可以直接作為監(jiān)控溫度平衡的替代性參數(shù)。IonFlux 系統(tǒng)可以實(shí)現(xiàn)從環(huán)境溫度至40°C 的變化。在一分鐘內(nèi)達(dá)到5°C 的溫度改變,一旦達(dá)到平衡后溫度將持續(xù)保持穩(wěn)定。

細(xì)胞準(zhǔn)備
表達(dá)了hERG1a 的中國倉鼠卵巢(CHO)細(xì)胞在37°C 和5% CO2 條件下培養(yǎng)在175cm2 頂部過濾的培養(yǎng)瓶中,培養(yǎng)基中含有DMEM、Glutamax-1 (Invitrogen,10565), 10%胎牛血清、和G-418 (500μg/ml)。細(xì)胞密度保持在90%以下,實(shí)驗(yàn)前轉(zhuǎn)移至30°C 培養(yǎng)箱過夜孵育。細(xì)胞收集時(shí),培養(yǎng)瓶先用2ml 的不含鈣離子和鎂離子的PBS 沖洗,然后加入5ml的Detachin.溶液處理2~5 分鐘。在細(xì)胞重懸轉(zhuǎn)移至外液中之前,1000rpm 離心90 秒。
溶液和化合物
細(xì)胞外液成分(ECS)含有(mM):NaCl 140, KCl 2, MgCl2 3, CaCl2 1, HEPES 10, 葡萄糖9,用NaOH調(diào)pH至7.4 。細(xì)胞內(nèi)液成分(ICS)含有(mM):KCl 120, MgCl2 5,CaCl2 10, EGTA 5, Tris-ATP 4,HEPES 10,,用KOH調(diào)pH至7.3。重懸在細(xì)胞外液中的細(xì)胞被加入至IonFlux(每毫升5x106個(gè)細(xì)胞)記錄板。本研究中采用的hERG 電壓刺激方案開始于+40mV并持續(xù)1秒,隨后在–50mV水平下持續(xù)1.5秒,每10秒重復(fù)一次此方案。細(xì)胞鉗制在-80mV。峰值尾電流在-50 mV時(shí)被記錄。
結(jié)果
溫度依賴 的藥理學(xué)特性
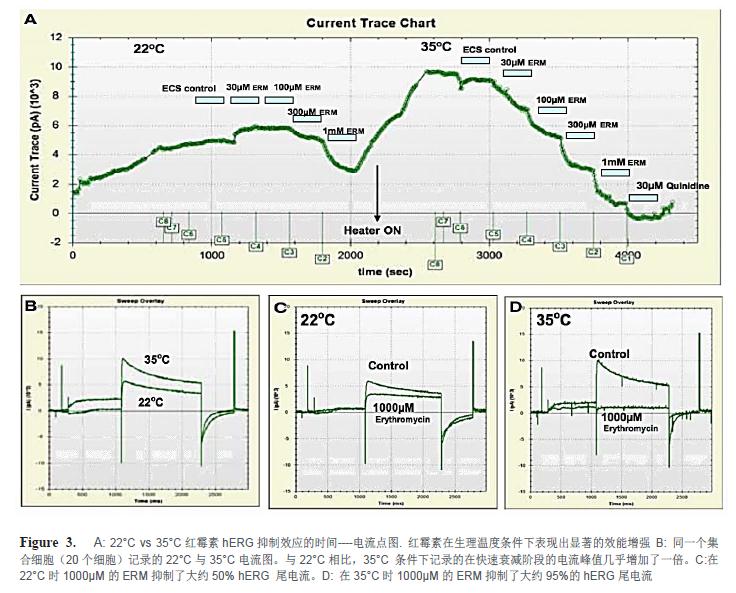
紅霉素(ERM)在生理溫度條件下具有顯著的效能增強(qiáng)特點(diǎn)。圖3A顯示了室溫條件下和生理溫度條件下ERM對hERG抑制效應(yīng)的時(shí)間--—電流點(diǎn)圖。此實(shí)驗(yàn)中細(xì)胞在室溫(22°C)條件下被捕獲和封接,以及記錄ERM的阻斷。直至添加了300µM ERM 后才觀察到顯著的抑制效應(yīng)。此抑制在沖洗后是可逆的。加熱功能在沖洗時(shí)開啟,溫度設(shè)置在35°C。當(dāng)溫度和電流穩(wěn)定后,重復(fù)添加不同濃度的ERM。使用IonFlux軟件中原始電流圖重疊功能,使得同一個(gè)集合細(xì)胞(20個(gè)細(xì)胞)記錄的22°C與35°C電流圖共同展現(xiàn)在圖3B中。與室溫條件相比,35°C 條件下記錄的在快速衰減階段的電流峰值幾乎增加了一倍。在22°C時(shí)1000µM的ERM抑制了大約50% hERG 尾電流(圖3C),而在35°C時(shí)同樣濃度的ERM抑制了大約95%的hERG尾電流(圖3D)此數(shù)值與文獻(xiàn)報(bào)道的結(jié)果完全一致(Kirsch, G.E, 2004, Stanat, S, 2003)。
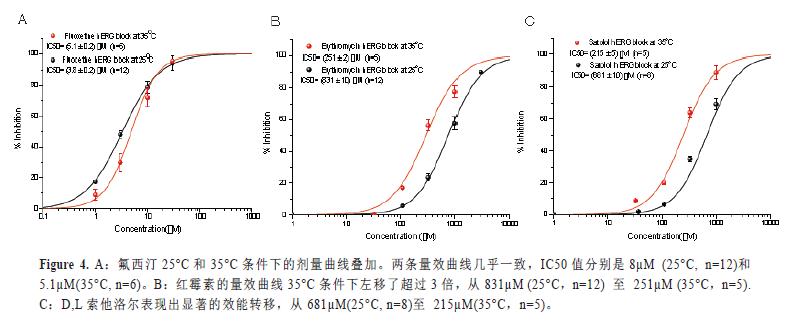
氟西汀是hERG的抑制劑,其不具體有溫度依賴的效能改變。在另一個(gè)實(shí)驗(yàn)中,氟西汀作為對照品與其它兩個(gè)化合物——紅霉素和D,L索他洛爾在同一塊記錄板中進(jìn)行檢測(IF-HT,384孔)。氟西汀25°C和35°C條件下的劑量曲線疊加顯示在圖4A中。兩個(gè)量效曲線大部分重疊在一起,IC50值分別是25°C時(shí)的3.8µM和35°C時(shí)的5.1µM。相反的,紅霉素的量效曲線35°C條件下左移了超過3倍,從831µM(25°C)至251µM (35°C),見圖4B。D,L索他洛爾同樣表現(xiàn)出顯著的效能轉(zhuǎn)移,從681µM(25°C)至215µM(35°C),見圖4C。結(jié)果表明氟西汀的hERG抑制效應(yīng)對溫度不敏感,而紅霉素和索他洛爾是溫度敏感的hERG阻斷劑。這些結(jié)果與文獻(xiàn)報(bào)道的一些明顯溫度依賴性化合物的結(jié)果一致(Kirsch,G.E,2004,Stanat,S,2003,Rajamani,S,2006,Thomas,D,2002)。
溫度依賴的動(dòng)力學(xué)特性
動(dòng)力學(xué)轉(zhuǎn)換的檢測提供更多關(guān)于溫度對離子通道電流影響的信息。我們研究比較了室溫和生理溫度條件下的hERG 原始電流圖(圖5)。首先,相比于22°C,35°C 條件下同一個(gè)集合細(xì)胞記錄的電流幅度幾乎超過兩倍。其次,去激活階段記錄的外向尾電流在35°C 時(shí)同樣表現(xiàn)出更快的衰減速度。單指數(shù)方程計(jì)算出的時(shí)間常數(shù)下降分別是22°C 時(shí)的938±16ms 和35°C 時(shí)的443±3ms。盡管時(shí)間常數(shù)的絕對值取決于激活的電壓刺激方案,但其分?jǐn)?shù)變化程度(即與室溫相比相差大約2~3 倍)與文獻(xiàn)報(bào)道是一致的(Zhou, Z. 1998)。

討論
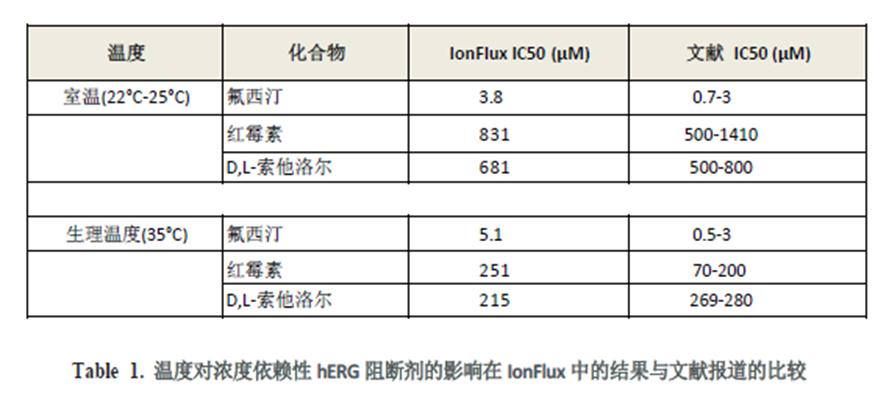
使用 IonFlux 溫度控制模塊,觀察到紅霉素與D,L 索他洛爾的抑制效應(yīng)對溫度是敏感的。在近生理溫度條件下獲得的檢測結(jié)果IC50 值比室溫條件下更低,但對于作為陰性對照的氟西汀,溫度變換并沒有表現(xiàn)出顯著的效應(yīng)改變。通過IonFlux 平臺(tái)記錄觀察到的藥理學(xué)效應(yīng)漂移與手動(dòng)膜片鉗數(shù)據(jù)是一致的(表1)。
動(dòng)力學(xué)研究表明hERG 尾電流峰值在生理溫度條件下幾乎增加兩倍,且去激活引起的外向尾電流的衰減速度加快了2~3 倍,此結(jié)果同樣與手動(dòng)膜片鉗數(shù)據(jù)是一致的。生理溫度條件下的hERG 篩選產(chǎn)生的數(shù)據(jù)可以與在體的心臟安全評價(jià)數(shù)據(jù)提供更好的相關(guān)性。因而,在藥物安全性評價(jià)實(shí)驗(yàn)中溫度是一個(gè)值得關(guān)注的因素。IonFlux 系統(tǒng)獨(dú)到的設(shè)計(jì)可以提供溫度控制模塊,便于開展溫度可能最為重要因素的hERG 安全性篩選和其它溫度依賴的離子通道靶標(biāo)。
參考文獻(xiàn):
Trudeau, M.C & Robertson G.A. (1995) Science 269, 92-95
Sanguinetti MC et al. (1995). Cell 81:299-307
Zhou Z, et al. (1998) Biophys J 74:230-41
Sale, H. & Robertson G. A. (2008) Circ. Res. 108 185249
Kirsch, G. E. (2004) J . Pharm. & Tox. Methods 50, 93-101
Stanat, S. (2003) Molecular &. Cellular Biochem. 254, 1-7
Rajamani, S.(2006) British J. of Pharm. 149, 481-489
Thomas, D.(2002) J. of Pharm. &Exp. Therapeutics 300, 543-548
標(biāo)簽:
膜片鉗 全自動(dòng)膜片鉗 hERG 通道
- 膜片鉗實(shí)驗(yàn)中顯微鏡載物臺(tái)振動(dòng)問題的原因及解決方案
- 集成的膜片鉗工作站的優(yōu)點(diǎn)及應(yīng)用優(yōu)勢
- 膜片鉗噪聲與干擾及其排除方法(一)(二)
- 膜片鉗助力通過patch-seq技術(shù)記錄小鼠GABA神經(jīng)元的轉(zhuǎn)錄和電生理特性
- 膜片鉗實(shí)驗(yàn)軟件Clampex對溫控溫度實(shí)時(shí)采集的設(shè)置方法
- 影響電生理實(shí)驗(yàn)的常見顯微鏡故障及解決方法之汞燈更換及對中調(diào)節(jié)
- ez-gSEAL 100B破膜儀在膜片鉗電生理實(shí)驗(yàn)封接破膜中的應(yīng)用優(yōu)勢
- Sophion離子通道篩選技術(shù)助力抗抑郁癥藥物新發(fā)現(xiàn)
Copyright(C) 1998-2024 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:[email protected]