細(xì)胞穿膜肽傳遞機(jī)理及研究前景
細(xì)胞穿膜肽傳遞機(jī)理及研究前景
德克薩斯A&M大學(xué)(TAMU)Jean-Phillipe Pellois博士研究組的興趣在于理解多肽如何溶解或者跨過生物膜,以及運(yùn)用這方面的知識(shí)開發(fā)能夠使蛋白滲透細(xì)胞的試劑。能夠使蛋白滲透到細(xì)胞在醫(yī)學(xué)或者細(xì)胞生物學(xué)上有很大潛在用途,這樣做最有吸引力的方法包括把蛋白吸附到類似于細(xì)胞穿膜肽(CPP)這樣的載體系統(tǒng)上。CPPs是一種攜帶大分子載體運(yùn)輸?shù)郊?xì)胞內(nèi)的多肽,其原型例子包括一種來源于HIV的多肽TAT(GRKKRRQRRR)。CPP-蛋白偶合物分兩步穿入細(xì)胞。首先,CPP-蛋白偶合物通過胞噬作用進(jìn)入細(xì)胞,這些分子位于細(xì)胞內(nèi),但是被捕獲在內(nèi)涵體內(nèi) (Fig 1A)。然后這些分子從內(nèi)涵體釋放出來,CPP-蛋白偶合物逃離內(nèi)涵體并進(jìn)入細(xì)胞的胞質(zhì)空間。

圖 1 通過促進(jìn)內(nèi)涵體溶解傳遞大分子。A)目前傳遞工具,例如類似于TAT的CPPs,不能使大分子從內(nèi)涵體釋放出來。B)內(nèi)涵體溶解肽E5-TAT促進(jìn)內(nèi)涵體的釋放,可通過簡(jiǎn)單的共孵育操作步驟用于傳遞大分子。C)多價(jià)結(jié)構(gòu)如三聚體TAT3同樣可使內(nèi)涵體釋放來傳遞大分子。
關(guān)于內(nèi)涵體釋放蛋白的機(jī)制了解不多。而且,該過程效率非常低。這代表了一個(gè)主要瓶頸,因?yàn)榈鞍孜磸膬?nèi)涵體成功逃離將不產(chǎn)生生物反應(yīng)。為了提高效率并且使蛋白能容易地傳遞到細(xì)胞,Pellois實(shí)驗(yàn)室正研究幾個(gè)促進(jìn)內(nèi)涵體釋放策略。問題是要使內(nèi)涵體的膜溶解而不引起其它細(xì)胞的膜破裂,因?yàn)檫@樣會(huì)導(dǎo)致細(xì)胞死亡。
通過pH啟動(dòng)的內(nèi)涵體溶解來傳遞
一種溶解內(nèi)涵體而不溶解其它膜的方法包括采用依賴pH值的具有溶解作用的多肽。這是基于內(nèi)涵體腔為酸性(pH 4.5-6.5),這提供了細(xì)胞內(nèi)特殊的化學(xué)環(huán)境。例如,多肽E5(GLFEAIAEFIENGWEGLIEGWYG)是流感HA2融合肽的類似物,該研究組考慮E5能否作為融合物促進(jìn)重組蛋白的傳遞。他們檢測(cè)到在酸性pH下E5質(zhì)子化并結(jié)合到脂質(zhì)雙層。然后,形成孔結(jié)合處足夠大可讓大蛋白通過膜擴(kuò)散[Ref 1]。為了研究這些多肽在細(xì)胞內(nèi)的活動(dòng),該研究組采用熒光蛋白E5-TAT-mCherry作為模型,在該系統(tǒng)中,E5用于溶解內(nèi)涵體,TAT用于蛋白內(nèi)噬作用,mCherry提供熒光信號(hào),以便在熒光顯微鏡下觀測(cè)。
Pellois研究組發(fā)現(xiàn),當(dāng)E5-TAT-mCherry同活細(xì)胞孵育時(shí),它能夠溶解內(nèi)涵體,但是即使在溶解發(fā)生后,E5使E5-TAT-mCherry仍然與內(nèi)涵體相聯(lián)。一種可能的解釋是,E5仍然不可逆地結(jié)合到內(nèi)涵體膜上,雖然E5導(dǎo)致了內(nèi)涵體溶解,但阻止了蛋白釋放。受這些結(jié)果鼓舞, Pellois研究組還顯示能夠通過與E5-TAT傳遞大分子,這適用于組織培養(yǎng)檢測(cè)(Fig 1B) [Ref 2]。E5-TAT能夠使細(xì)胞吸入其周圍含大分子的培養(yǎng)基。因此,E5-TAT和共孵育的大分子能夠共同聚集到內(nèi)涵體。一旦內(nèi)涵體酸化,E5-TAT導(dǎo)致了內(nèi)涵體溶解,位于內(nèi)涵體腔的大分子自由逃逸到細(xì)胞質(zhì)空間并發(fā)揮其生物功能。
采用具有分支的CPPs的傳遞
要改進(jìn)CPPs內(nèi)涵體溶解活性的想法是創(chuàng)新多價(jià)系統(tǒng)來增加在內(nèi)涵體膜上局部濃度。Pellois研究組探索了通過合成多個(gè)TAT拷貝(TATn, n = 2, 3, 4, 5 ,6 ) 的分支狀分子的方法[Ref 3]。類似于TAT,TAT2進(jìn)入內(nèi)涵體,不能溶解內(nèi)涵體。TAT4、TAT5、TAT6都不能改進(jìn)大分子傳遞,因?yàn)檫@些化合物結(jié)合到細(xì)胞質(zhì)膜上不活躍。相比之下,TAT3是獨(dú)特的,因?yàn)�,該�?gòu)造能夠溶解內(nèi)涵體并比其它多聚體類似物更有效地把大分子傳遞到細(xì)胞質(zhì)膜(Fig 1C)。目前,他們正研究TAT3在分子水平上能否使內(nèi)涵體膜溶解以及TAT自身如何行使其自身功能的。
用閃光啟動(dòng)內(nèi)涵體溶解的傳遞
用溶解內(nèi)涵體的第三個(gè)有吸引力的方法用可見光激發(fā)內(nèi)涵體里存在的TAT熒光復(fù)合物。Pellois研究組證明用TMR(tetramethylrhodamine,四甲基羅丹明)標(biāo)記TAT的TMR-TAT在照射后幾秒內(nèi)能夠溶解內(nèi)涵體(Fig 2)。該作用是根據(jù)一旦激發(fā)TMR,膜上就產(chǎn)生活性單個(gè)游離重態(tài)氧分子[Ref 4]。他們的模型是多肽把附近的熒光素帶到膜上,雖然熒光素當(dāng)時(shí)不產(chǎn)生單個(gè)游離態(tài)氧,但是它局部導(dǎo)致膜組分輕易破壞。該方法是有趣的,因?yàn)樗赡墚a(chǎn)生了一種方法學(xué),研究者可采用該方法對(duì)傳遞事件在時(shí)間和空間上進(jìn)行控制,允許他們實(shí)時(shí)研究某個(gè)既定分子在胞內(nèi)濃度突然增加的作用。
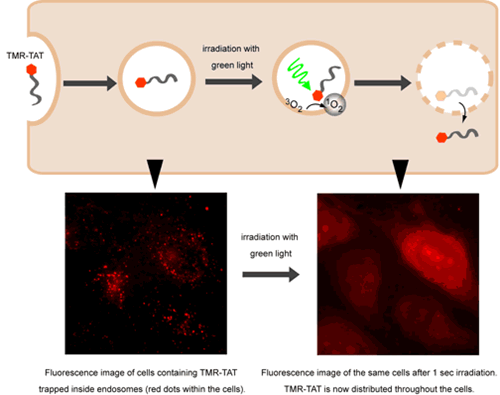
圖 2 一旦用綠光照射,熒光螯合物TMR-TAT就從內(nèi)涵體釋放出來。
未來的研究方向
許多問題仍需要解決:這些試劑在分子水平上是如何溶解膜的?在胞吞途經(jīng)運(yùn)輸時(shí)被傳遞的大分子降解嗎?溶解內(nèi)涵體的生理作用是什么?解決這些問題來使內(nèi)涵體溶解試劑活性達(dá)到最優(yōu)傳遞條件。Pellois研究組目前也試驗(yàn)他們的方法用于對(duì)把轉(zhuǎn)錄因子傳遞到細(xì)胞內(nèi)。現(xiàn)在的目標(biāo)是重新編程和操作人類細(xì)胞以獲得組織修復(fù)。最后,他們正采用從內(nèi)涵體裂解獲得教訓(xùn)來開發(fā)能有效裂解細(xì)菌膜的多肽試劑。這一方面,目的是學(xué)會(huì)如何殺死細(xì)菌而不殺死人的健康細(xì)胞。
參考文獻(xiàn)
1. Lee, Y. J.; Johnson, G.; Pellois, J. P. Biochemistry 2010, 49, 7854.
2. Lee, Y. J.; Erazo-Oliveras, A.; Pellois, J. P. Chembiochem 2010, 11, 325.
3. Angeles-Boza, A. M.; Erazo-Oliveras, A.; Lee, Y. J.; Pellois, J. P. Bioconjug Chem 2010, 21, 2164.
4. Srinivasan, D.; Muthukrishnan, N.; Johnson, G. A.; Erazo-Oliveras, A.; Lim, J.; Simanek, E. E.; Pellois, J. P. PLoS ONE 2011, 6, e17732.
- 人細(xì)胞色素P450 4A11(CYP4A11)ELISA檢測(cè)試劑盒使用說明書
- 果蠅DNA甲基轉(zhuǎn)移酶(DNMT)ELISA檢測(cè)試劑盒使用說明書
- 抗體親和提取(AAE™):革新宿主細(xì)胞蛋白(HCPs)分析的新篇章
- 斑馬魚淀粉樣前體蛋白(APP)ELISA檢測(cè)試劑盒使用說明書
- 人adropin(AD)ELISA檢測(cè)試劑盒使用說明書
- 血液唾液皮質(zhì)醇水平和兒童多動(dòng)癥(ADHD)的關(guān)系
- 小鼠環(huán)磷酸鳥苷(cGMP)ELISA檢測(cè)試劑盒使用說明書
- 血液中內(nèi)皮脂肪酶水平與動(dòng)脈粥樣硬化性心血管疾病的關(guān)系
Copyright(C) 1998-2024 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:[email protected]